ملاحظات روش، کاربرد و ایمنی ( کلیات و اساس کاتسو BFR)
این مطالعه مجموعهای از دستورالعملها برای تمرین محدودیت جریان خون، با تمرکز بر روش، کاربرد و ایمنی این تکنیک را ارائه میدهد. با ظهور این تکنیک و طیف گسترده ای از برنامه های کاربردی در منابع، هدف از این بررسی ارائه یک راهنمای آگاهانه تحقیق در مورد آموزش محدودیت جریان خون برای پزشکان است. این امر شامل استفاده از محدودیت جریان خون برای تقویت قدرت عضلانی و هیپرتروفی از طریق تمرین با مقاومت و ورزش هوازی و جلوگیری از آتروفی عضله با استفاده از این روش به طور منفعل است. تیم تألیفی این مقاله از بین محققان متمرکز در تحقیق آموزش محدودیت جریان خون با تخصص در علوم ورزشی، قدرت و تعلیم و پزشکی ورزشی انتخاب شده است.
مقدمه
محدودیت جریان خون (BFR ) یک روش آموزشی تمرین است که در عضلات در حال کار در حین ورزش تا حدوی جریان شریانی و بطور کامل خروج ورید را محدود می کند (Scott et al., 2015). انجام ورزش با کاهش جریان خون که با محدود شدن عروق مجاور عضله حاصل می شود، به دکتر یوشیاکی ساتو (Dr. Yoshiaki Sato) در ژاپن برمی گردد، جایی که به عنوان “تمرین کاتسو” شناخته می شد، به معنی “تمرین با فشار بیشتر و اضافی”. تمرین کاتسو اکنون در سراسر جهان انجام می شود و معمولاً “به عنوان BFR نامیده می شود و با استفاده از سیستم تورنیکت پنوماتیک حاصل می شود (Wernbom et al., 2008; Loenneke et al., 2012d ).
تکنیک BFR در عضله با استفاده از سیستم تورنیکت پنوماتیک شامل ایجاد فشار خارجی، معمولاً با استفاده از کاف تورنیکت، به مجاور ترین ناحیه اندام فوقانی و یا تحتانی است. هنگامی که کاف باد می شود، فشرده سازی تدریجی مکانیکی سیستم عروق در زیر کاف رخ می دهد، و منجر به محدود شدن جزئی جریان خون شریانی (سرخرگ) به ساختارهای (اندام های) دور از کاف می شود، اما این امر با شدت بیشتری روی خروجی جریان وریدی از زیر کاف اثر می گذارد و همچنین مانع بازگشت جریان به سرخرگ نیز می شود. فشرده سازی سیستم عروقی نزدیک به عضله اسکلتی به تأمین اکسیژن ناکافی (هیپوکسی) در بافت عضله منجر می شود (Manini and Clark, 2009; Larkin et al., 2012). علاوه بر این، کاهش جریان خون وریدی منجر به جمع شدن خون در مویرگهای اندام مسدود شده می شود که اغلب توسط سرخ شدگی قابل مشاهده منعکس می شود. میزان جمع شدن خون ممکن است تحت تأثیر فشار وارد شده باشد. علاوه بر این، هنگامی که تحت شرایط BFR انقباضات عضلانی انجام می شود، افزایش فشار درون عضلانی در زیر کاف وجود دارد (Kacin et al., 2015)، که جریان خون را بیشتر مختل می کند.
در حالی که تعداد گروه های تحقیقاتی و مطالعات تحقیق در مورد BFR افزایش یافته است، تعداد پزشکان نیز که از این شیوه آموزش استفاده می کنند، افزایش یافته است (Patterson et al., 2017). این یک خبر مثبت است، اما بررسی های Patterson et al. (2017) نشان می دهد که پزشکان هنوز اطلاعات کافی در مورد چگونگی استفاده و بکارگیری BFR مطابق با تحقیقات فعلی که استاندارها را بیان می کنند، ندارند. به عنوان مثال، فشارهای وسیعی توسط پزشکان اعمال شد که منجر به عواقب ناخواسته ای مانند بروز بی حسی زیاد به دنبال BFR شد. بنابراین، هدف از این بررسی ارائه راهنمای آگاهانه و تحقیقاتی BFR از گروهی از متخصصان برجسته جهان در این زمینه است. پیش بینی شده است که این امر باعث می شود تا پزشکان در تصمیم گیری درباره دلایل استفاده از BFR، نحوه استفاده از BFR و همچنین درک موارد ایمنی مرتبط با آموزش BFR، با آگاهی و وضوح بیشتری عمل کنند. برای درک دقیق تر مکانیسم های تمرین BFR، ما خوانندگان را به مقاله های مروری زیر ارجاع می دهیم (Wernbom et al., 2008; Pearson and Hussain, 2015).
کاربرد BFR
BFR در طول هر دو تمرین مقاومت داوطلبانه (BFR-RE ) و ورزش هوازی ایروبیک (BFR-AE )، و همچنین منفعلانه بدون ورزش (P-BFR ) اعمال می شود. تحقیقات جدیدتر ترکیبی از BFR با ابعاد ورزش غیر سنتی، مانند تکنیک های لرزش کل بدن و تحریک الکتریکی عصبی عضلانی را بررسی کرده اند.

پروتکل هایی برای تقویت قدرت عضلات و هایپرتروفی
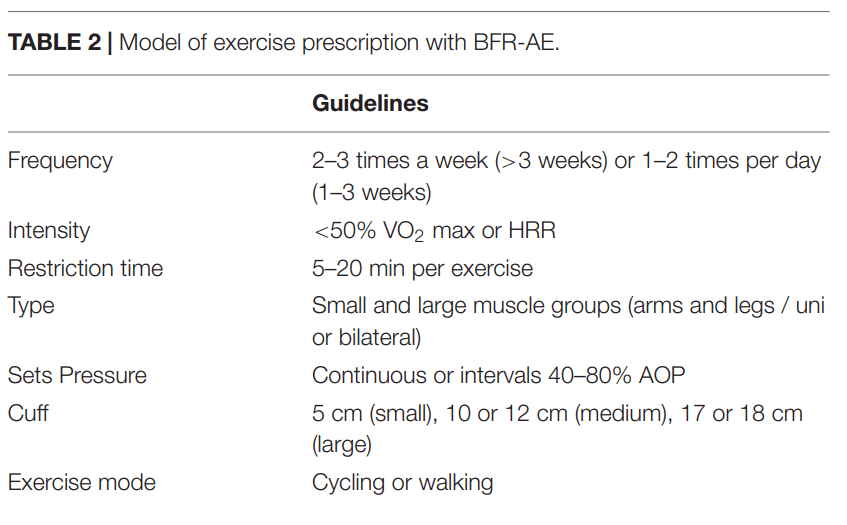
در بخش زیر، مروری بر منابع BFR با هدف افزایش حداکثر قدرت عضله اسکلتی و توده عضلانی ارائه می شود. جداول 1، 2 به ترتیب یک نمای کلی از توصیه های مربوط به کاربرد BFR-RE و BFR-AE را ارائه می دهند.

تمرین مقاومت داوطلبانه (BFR-RE )
افزایش هیپرتروفی و قدرت عضلات با BFR-RE به طور گسترده ای ثبت شده است. در سال های اخیر، تعدادی از بررسی های سیستماتیک و متاآنالیزها BFR-RE را نشان داده است تا به طور موثر قدرت عضله اسکلتی و یا هیپرتروفی را در جوانان سالم (Loenneke et al., 2012d; Slysz et al., 2016; Lixandrão et al., 2018) و افراد مسن تر (Centner et al., 2018a; Lixandrão et al., 2018)، و همچنین جمعیت های به خطر افتاده که نیاز به توان بخشی دارند (Hughes et al., 2017) افزایش می دهد. درجات و میزان مختلف قدرت عضلات در پاسخ به مداخلات BFR-RE شامل ایزوتونیک پویا (Burgomaster et al., 2003; Moore et al., 2004 )، ایزومتریک (Takarada et al., 2000a; Moore et al., 2004) و مقاومت ایزوكینتیك (Takarada et al., 2000c, 2004 Burgomaster et al., 2003; Moore et al., 2004) و همچنین سرعت توسعه نیرو / ظرفیت مقاومت ناگهانی (Nielsen et al., 2017b ) بهبود یافته است. به خوبی نشان داده شده است که در اکثر موارد هایپرتروفی عضلات و سازگاری قدرت در BFR-RE به طور قابل توجه و معنی داری بیشتر از مواردی است که فقط در ورزش با مقاومت در برابر بار کم (LL-RE) به تنهایی حاصل می شود (Takarada et al., 2002, 2004; Abe et al., 2005a,b,c; Yasuda et al., 2005) اما همه مطالعات (Farup et al., 2015 ) بیانگر این موضوع نیستند. چنین سازگاری هایی تنها پس از 1-3 هفته مشاهده شده است (Abe et al., 2005a,b, 2006; Fujita et al., 2008; Nielsen et al., 2012; Yasuda et al., 2005 ). این بازه های زمانی برای افزایش اولیه قدرت در تحقیقات مربوط به ورزش با مقاومت بالا (HL-RE ) منعکس شده است (Blazevich et al., 2017 )، با این حال، این مورد معمولاً در مورد توده عضلانی که در آن سازگاری پس از 1-3 هفته با بکارگیری HL-RE رخ داده، دیده نشده است (Damas et al., 2016).
اگرچه افزایش اندازه عضلات ممکن است تا حدی نتیجه تورم حاد مشاهده شده در طی و بعد از BFR-RE باشد (Loenneke et al., 2012c; Pearson and Hussain, 2015 )، هنوز بهبودهایی بین 2 تا 10 روز بعد از تمرین مشاهده می شود (Abe et al., 2005a; Fujita et al., 2008; Nielsen et al., 2012 ). بنابراین، به نظر می رسد که BFR-RE امکان اضافه شدن زود هنگام توده عضلانی اسکلتی را فراهم می کند. اگرچه باید توجه داشت که این رشد عضلانی سریع به دلیل توانایی استفاده از BFR-RE با فرکانس تمرین بالا است که با HL-RE همیشه امکان پذیر نیست. به عنوان مثال، ریکاوری برای بارهای کمتری که در طول BFR-RE استفاده می شوند به میزان مدت زمان مورد استفاده برای بازیابی از HL-RE طولانی تر نمی شوند و بنابراین به دلیل این نیازهای مکانیکی کمتر، این امر ممکن است برای یک فرکانس آموزش بالاتر امکان پذیر باشد. هیپرتروفی عضلات با تکرار تمرین معمول (2-3 بار در هفته) به دنبال مدت زمان طولانی تر تمرین 3 هفته ای (Ladlow et al., 2018)، 5 هفته ای (Manimmanakorn et al., 2013)، 6 هفته ای (Thiebaud et al., 2013) و 8 هفته یا بیشتر (Moore et al., 2004; Libardi et al., 2015; Yasuda et al., 2016; Cook et al., 2017) مشاهده شده است روش BFR-RE قدرت عضلات را در مقایسه با LL-RE به تنهایی بهبود می بخشد (Hughes et al., 2017 ) اما به طور کلی در مقایسه با HL-RE افزایش قدرت عضلانی کمتری نشان می دهد (Loenneke et al., 2012d; Hughes et al., 2017; Lixandrão et al., 2018). بررسی های پیشرفته و گسترده اخیرLixandrão et al. (2018) افزایش قدرت عضلانی برتر برای HL-RE را در مقایسه با BFR-RE حتی هنگام تنظیم برای تعدیل کنندگان بالقوه [به عنوان مثال، ویژگی آزمون (پویا یا ایزومتریک)، عرض کاف، فشار انسداد مطلق و روش تجویز فشار انسداد] را نشان داد. از طرف دیگر، همان بررسی نشان داد که صرف نظر از عرض کاف، فشار انسداد مطلق و روش تجویز فشار انسداد، BFR-RE باعث افزایش قابل توجه توده عضلانی در مقایسه با هنگام کار با HL-RE می شود. بنابراین، ما پیشنهاد می کنیم که اگرچه افزایش قدرت عضلانی مشاهده شده در BFR-RE در مقایسه با HL-RE کمتر است، BFR از LL-RE به تنهایی موثرتر است و می تواند در صورتی که HL-RE قابل توصیه نیست (به عنوان مثال، توانبخشی بعد از عمل، توانبخشی قلب، بیماریهای التهابی و افراد مسن ضعیف) مورد استفاده قرار گیرد. هنگامی که رشد توده عضلانی در نظر گرفته شود، به نظر می رسد که هر دو BFR-RE و HL-RE به یک اندازه موثر باشند. آتروفی استفاده نادرست یک عارضه مکرر در جمعیت های بالینی است که باعث می شود BFR-RE جایگزین بالقوه ای برای HL-RE بخصوص برای از دست دادن توده عضلانی باشد.

تعیین فشار کاف
میزان فشار مورد نیاز برای قطع جریان خون به یک اندام [یعنی فشار انسداد شریانی (AOP) ] به طیف وسیعی از خصوصیات اندام از جمله شکل، عرض و طول تورنیکت، اندازه اندام یا فشار خون فرد (Loenneke et al., 2012b, 2015; Jessee et al., 2016; McEwen et al., 2018) مرتبط است. اندام بزرگتر به فشار کاف بیشتری برای محدود کردن جریان خون شریانی نیاز دارند، که این امر در طیف وسیعی از عرض کاف ها صدق می کند (Loenneke et al., 2012b). برخی از محققان اظهار داشته اند فشار می تواند با توجه به فرد، عرض كاف و جنس مواد کاف از طریق تنظیم نسبت به فشار انسداد شریانی كاف كه در حین ورزش از آن استفاده می شود، تنظیم گردد (% AOP; Patterson et al., 2017; McEwen et al., 2018). این کار را می توان با تورم کاف در حین ورزش استفاده می شود تا جایی که جریان خون متوقف می شود (100% AOP) و استفاده از درصدی از آن فشار (به عنوان مثال 40-80 درصد از AOP) در حین ورزش انجام داد. اگرچه برخی فشارها را نسبت به فشار خون انقباضی بازویی (SbP) (فشار خون سنتی ؛ Brandner et al., 2015) بکار برده اند، این ممکن است باعث کاهش مداوم جریان خون نشود، مگر اینکه کاف مورد استفاده برای فشار خون سنتی همان کاف مورد استفاده در حین ورزش باشد (Loenneke et al., 2012b). اینکه فشار خون سنتی در بازو چقدر خوب به پا (اندام بزرگتر) وارد می شود نیز یک مورد است که می تواند در این روش در نظر گرفته شود (Loenneke et al., 2016). علاوه بر این، مشخص شده است که SbP با اندازه گیری فشار انسداد شریانی همبستگی کمی دارد (Younger et al., 2004). علی رغم اینکه برخی از محققان توصیه می کنند فشار به نسبت اندام تحت فشار اعمال شود، اکثر مطالعات اولیه، مستقل از عرض کاف و اندازه اندام، فشار مطلق یکسانی را بر روی هر فرد اعمال کردند. این فشارها از فشارهای مطلق تا 50 میلی متر جیوه (Kubota et al., 2011) تا 300 میلی متر جیوه (Cook et al., 2007) متغیر بوده اند. اگرچه اکثر مطالعات سازگاری عضلانی مفید و موثری را با همان فشارهای مطلق اعمال شده بر هر فرد ایجاد کرده اند، اما به نظر می رسد فشار BFR بیشتر می تواند پاسخ قلبی عروقی را افزایش دهد و اغلب باعث ناراحتی مرتبط با این نوع ورزش می شود (Jessee et al., 2017; Mattocks et al., 2017). بنابراین توصیه می شود که فشار را در حین تمرین BFR بر اساس اندازه گیری AOP تنظیم کنید، فشارهایی متغیر از 40 تا 80٪ AOP که شواهدی برای اثبات اثربخشی آن ها داشته باشد.
عرض کاف
مقدار فشار لازم برای قطع جریان خون به یک اندام (یعنی AOP) تا حد زیادی توسط عرض کاف اعمال شده بر روی اندام تعیین می شود. یک کاف عریض تر، اساساً به دلیل سطح بیشتری که فشار به آن وارد می شود، به فشار کمتری نیاز دارد (Crenshaw et al., 1988; Loenneke et al., 2012b; Jessee et al., 2016). این یک نکته مهم است زیرا طیف گسترده ای از عرض کاف (3–18 سانتی متر) وجود دارد که در منابع و مطالعات مربوط به BFR استفاده شده است و تنظیم و بکارگیری دو کاف با اندازه های متفاوت برای یک فشار مشابه ممکن است درجه کاملا متفاوتی از اندام BFR را تولید کند (Rossow et al., 2012 ). ذکر شده است که اعمال فشار نسبی 40٪ AOP منجر به کاهش 40٪ جریان خون نمی شود (Mouser et al., 2017b ). با این وجود، یک مطالعه اخیرا نشان داد که اعمال فشار به عنوان یک درصد فشار خون (AOP) به سه کاف مختلف با اندازه های متفاوت، تغییر مشابهی را در جریان خون در حالت استراحت ایجاد می کند (Mouser et al., 2017a). این مطالعه نشان داد که یک کاف عریض فشار کمتری را برای محدود کردن جریان خون در هر درصد از AOP نیاز دارد، اما یک کاف باریک با فشار مطلق بالاتر (اما همان٪ AOP مشابه با فشار گسترده) کاهش مشابهی در جریان خون دارد. اگرچه فشارهای کمتری با یک کاف عریض می تواند استفاده شود، اما این لزوماً با محرک ایمن تری برابر نیست بلکه نشان دهنده توانایی ذاتی هر یک از اندازه های کاف برای اعمال فشار از طریق لایه های بافتی در یک اندام است (Crenshaw et al., 1988 ). سرانجام، ما تصدیق می کنیم که ممکن است دقیقا در جایی که کاف اعمال می شود، مقداری کاهش رشد وجود داشته باشد (Kacin and Strazar, 2011; Ellefsen et al., 2015)، اگرچه یک مطالعه نشان می دهد که اگر یک درصد از AOP اعمال شود ممکن است از این کاهش رشد جلوگیری شود (Laurentino et al., 2016). بنابراین، توصیه می شود که در صورتی که فشار بطور مناسب با توجه به AOP تنظیم شود طیف گسترده ای از عرض کاف را می توان استفاده کرد. لازم به ذکر است که هرچه پهنای کاف بیشتر باشد فشار کلی کمتری لازم است، با این حال، استفاده از کاف های بسیار پهن ممکن است حرکت را در حین ورزش محدود کند.
جنس کاف
در مطالعات و منابع، معمولاً از کاف های کش دار و نایلونی استفاده می شود. در قسمت پایین تنه (Loenneke et al., 2013, 2014b)، به نظر می رسد تفاوت کمی در استراحت انسداد شریانی یا تکرارها برای شکست متحدالمرکز (هم محور) (جایگزین یا نماینده برای جریان خون) با استفاده از کافهای با عرض یکسان ساخته شده از دو ماده مختلف (الاستیک در مقابل نایلون) وجود دارد. در قسمت بالاتنه (Buckner et al., 2017)، با استفاده از كاف ساخته شده از مواد مختلف اما اندازه یکسان (3 در مقابل 5 سانتیمتر)، اختلاف زیادی در AOP در حالت استراحت وجود داشت كه بعید به نظر می رسد به دلیل اختلاف کم در عرض کاف باشد. با این حال، هنگامی که فشار به عنوان یک درصد AOP به هر کاف ایجاد شد، تکرارهای شکست ارادی بین دو ماده مختلف کاف مشابه بود. این تایید کننده این است که کاهش جریان خون در حین تمرین احتمالاً بین اندازه کاف های مختلف مشابه بوده است. به نظر می رسد که می توان هرگونه اختلاف در ماده کاف را به سادگی با اعمال فشار نسبت به کل AOP خاص برای هر کاف اصلاح کرد. اگرچه مطالعات در طول یک مطالعه آموزشی هرگز به طور مستقیم اثر مواد کاف را مقایسه نکرده اند، اما هیچ مدرکی در دسترس نیست که نشان دهد یک ماده کاف از دیگری برتر است. بعلاوه، از کافهای الاستیک و نایلون در منابع استفاده شده است و سازگاری های عضلانی مفیدی را نشان داده اند (Fahs et al., 2015; Kim et al., 2017). با در نظر گرفتن این یافته های عمومی، به نظر نمی رسد که مواد کاف بر نتایج BFR-RE تأثیر بگذارد.
بار ورزش، حجم، دوره های استراحت، مدت زمان و فرکانس
بار ورزش
فشار وارد شده در حین تمرین نیز ممکن است تا حدودی توسط بار نسبی برداشته شده در حین تمرین مقاومتی تحمیل شود. برای اکثر افرادی که با بارهای مربوط به 40-40٪ از حداکثر سطح قدرت فرد ورزش می کنند (به عنوان مثال 1-RM) احتمالاً رشد و قدرت عضلانی را به حداکثر برسانند (Lixandrao et al., 2015; Counts et al., 2016). هنگامی که بارهای مورد استفاده در انتهای پایین این توصیه هستند (به عنوان مثال، حدود 20 درصد از 1-RM)، ممکن است فشار بیشتری (حدود 80 درصد AOP) بطور ضروری برای نمایان شدن عضلات لازم باشد (Lixandrao et al., 2015)، با این حال، بررسی بیشتر برای تأیید این امر ضروری است. اکثر مطالعات، خم کننده های آرنج و منبسط کننده های زانو را بررسی کرده اند و مشخص نیست که آیا گروه های مختلف عضلانی به توصیه های فشار متفاوتی نیاز دارند. به عنوان مثال، پیشنهاد شده است که هدف قرار دادن گروه های عضلانی نزدیک به کاف ممکن است برای سازگاری حداکثر به فشار اعمال شده بیشتری نیاز داشته باشد (Dankel et al., 2016). در نتیجه، ما پیشنهاد می کنیم که از بارهای ورزشی بین 20 تا 40٪ 1RM استفاده شود زیرا این طیف از بارها هنگام ترکیب با BFR به طور مداوم سازگاری های عضلانی ایجاد می کند.

حجم
در منابع BFR-RE، یک مجموعه تکراری معمول و متداول وجود دارد که شامل 75 تکرار در چهار مجموعه تمرین، با 30 تکرار در مجموعه اول و 15 تکرار در هر مجموعه بعدی است (Yasuda et al., 2006, 2010a,b, 2011a,b, 2012; Madarame et al., 2008; Rossow et al., 2012; Ozaki et al., 2013; Loenneke et al., 2016; May et al., 2017). همچنین تکمیل 3-5 مجموعه از شکست متحدالمرکز (هم محور) در طول BFR-RE معمول است (Takarada et al., 2002; Cook et al., 2007, 2013; Loenneke et al., 2012a; Manini et al., 2012; Nielsen et al., 2012; Ogasawara et al., 2013; Fahs et al., 2015). بعلاوه، تکرارهای عدم موفقیت ممکن است در تنظیمات عملی، مانند توانبخشی بعد از جراحی در جمعیت بالینی مورد نیاز نباشد. به عنوان مثال، به نظر نمی رسد که دو برابر شدن این حجم بار برداشته شده، هیچ سازگاری را افزایش دهد (Loenneke et al., 2011b; Martín-Hernández et al., 2013)، اگرچه رابطه دوز-پاسخ بین حجم و سازگاری هنوز به وضوح و روشنی بیشتری نیاز دارد. بنابراین، 75 تکرار، در چهار مجموعه (30، 15، 15، 15) حجم پیشنهاد می شود که کافی باشد تا منجر به سازگاری در بیشتر افراد شود. تلاش برای شکست، امکان دیگری برای ایجاد سازگاری است اما ممکن است همیشه مورد نیاز نباشد.
دوره های استراحت
دوره های استراحت بین مجموعه ای که در طول BFR-RE استفاده می شود معمولاً کوتاه است و به طور معمول محدودیت در این دوره حفظ می شود. به عنوان مثال، Loenneke et al. (2012d) یک مطالعه را که سازگاری قدرت را با هر دو دوره 30 و 60 ثانیه استراحت بین مجموعه ای نشان می داد انجام داند. برخی از تحقیقات بحرانی از دوره های استراحت تا 150 ثانیه استفاده کرده اند (Loenneke et al., 2010 )، اما مشخص نشد که این امر باعث افزایش استرس متابولیک بیش از LL-RE می شود، بنابراین ممکن است مزایای آموزشی ایجاد نکند. با این حال، دوره های استراحت هر دوی 30 ثانیه (Yasuda et al., 2010a, 2015b; Loenneke et al., 2011a ) و 30-60 ثانیه (Madarame et al., 2010; Patterson and Ferguson, 2010, 2011; Yasuda et al., 2015b; Loenneke et al., 2016; Ladlow et al., 2018) در منابع BFR معمول است، که منعکس کننده توصیه هایی برای دستیابی به هایپرتروفی عضلات اسکلتی است (Kraemer and Ratamess, 2004 ). در بعضی مواقع همیشه لازم نیست که فشار را در دوره های استراحت حفظ کنید. به عنوان مثال، Yasuda et al. (2013) فعال سازی عضلانی مشابهی را با فشار مداوم و متناوب در دوره های استراحت نشان داند، اما فقط هنگامی که فشار کاف بالا اعمال شد. به طور کلی ما توصیه می کنیم که دوره های استراحت باید 30-60 ثانیه تشکیل شود، با این حال، BFR متناوب ممکن است تورم / استرس متابولیکی را در مقایسه با تداوم کاهش دهد، که می تواند استرس را برای سازگاری محدود کند.
فرکانس
به طور سنتی، برای تحریک هایپرتروفی عضلات اسکلتی و سازگاری های قدرتی، توصیه می شود 2-4 بار تمرین مقاومتی انجام شود (Fleck and Kraemer، 2004؛ Kraemer and Ratamess، 2004). افزایش هیپرتروفی و قدرت عضلات با BFR-RE دو بار در هفته گزارش شده است (Takarada et al., 2000b, 2002; Laurentino et al., 2008; Madarame et al., 2008)، با یک بررسی اخیر که طرفدار 2- 3 جلسه BFR-RE در هفته با اضافه بار پیشرونده برای افزایش قدرت و سازگاری هایپرتروفی کافی است (Scott et al., 2015). برخی از تحقیقات BFR روزانه دوبار تمرین را اجرا کرده اند (Abe et al., 2005b; Yasuda et al., 2005, 2010b; Nielsen et al., 2012) که ممکن است برای تسریع بهبود در شرایط توان بخشی بالینی استفاده شود (Ohta et al., 2003; Ladlow et al., 2018). در نتیجه، ممکن است از رویه های با فرکانس بالا (1-2 بار در روز) برای دوره های کوتاه مدت (1-3 هفته) استفاده شود، با این حال، در دوره های برنامه ریزی طبیعی، 2-3 جلسه در هفته ایده آل است.
مدت زمان برنامه های تمرینی
با توجه به مدت زمان برنامه های BFR-RE، هیپرتروفی عضلات و سازگاری قدرت در بازه های زمانی کوتاه مدت، از جمله 1 تا 3 هفته مشاهده شده است (Abe et al., 2005b,c; Yasuda et al., 2005; Fujita et al., 2008; Nielsen et al., 2012). بیشتر مطالعات هیپرتروفی عضله و سازگاری قدرت را در طول مدت زمان بیشتر از 3 هفته بررسی کرده اند (Burgomaster et al., 2003; Moore et al., 2004; Abe et al., 2006; Iida et al., 2011; Nielsen et al., 2012; Yasuda et al., 2012; Martín-Hernández et al., 2013; Luebbers et al., 2014; Kang et al., 2015 ).
BFR-AE
BFR-AE در بررسی های سیستماتیک نشان دهنده اثربخشی افزایش قدرت و هیپرتروفی در جمعیت جوان (Slysz et al., 2016) و افراد مسن (Centner et al., 2018a) است. کاربرد BFR-AE معمولاً در حین پیاده روی (Abe et al., 2006) یا ورزش دوچرخه سواری اتفاق می افتد (Abe et al., 2010a; Conceição et al., 2019 ). سازگاری برای قدرت و هیپرتروفی عضلات اسکلتی در کمتر از 3 هفته شده است (Abe et al., 2006). اما بعد از حداقل 6 هفته آموزش بسیار موثر است (Slysz et al., 2016). با بکارگیری BFR-AE افزایش قدرت عضلات اسکلتی تا 7-27٪ (Abe et al., 2006, 2010a,b; Ozaki et al., 2011a,b; de Oliveira et al., 2016; Clarkson et al., 2017a; Conceição et al., 2019) و هیپرتروفی تا 3-7٪ (Abe et al., 2006, 2010a,b; Ozaki et al., 2011a,b; Sakamaki et al., 2011; Conceição et al., 2019) نشان داده شده است. علاوه بر این، این روش ورزش همچنین توانایی عملکردی را در طیف وسیعی از کارها بهبود می بخشد (Clarkson et al., 2017a)، که نشان دهنده تأثیر افزایش قدرت و توده عضلانی از BFR-AE بر فعالیت های مربوط به زندگی روزمره، سلامتی و سلامتی است. در کنار این تغییرات، BFR-AE همچنین می تواند به پیشرفت قابل توجهی در ظرفیت هوازی در افراد جوان (Slysz et al., 2016)، مسن (Abe et al., 2010a) و حتی افراد آموزش دیده منجر شود (Park et al., 2010) اما این همیشه اینگونه نیست. شدت مورد استفاده در طول BFR-AE به طور کلی ماهیت کمی دارد (45٪ ذخیره ضربان قلب یا 40٪ حداکثر VO2 ؛ Abe et al., 2010a; Clarkson et al., 2017a; Conceição et al., 2019) و در برخی موارد استاندارد نشده اند (Abe et al., 2006, 2010b; Clarkson et al., 2017a ) یا با طیف گسترده ای از عرض و فشارهای کاف اجرا شده اند. مجموعه كوچكتري از منابع تغييراتي را در BFR-AE، كه در آن BFR بلافاصله پس از تلاش هوازي اعمال مي شود، مورد بررسي قرار داده اند. سازگاری ها، یک بهبود اغراق آمیز در حداکثر VO2 و پتانسیل سازگاری های هوازی بیشتر در نتیجه تنظیم بیش از حد حاد علامت دهی پروتئین را نشان می دهد (Taylor et al., 2016)، همانطور که در ورزشکاران بسیار آموزش دیده مقایسه BFR-AE با سیستم های همسان هیپوکسی نیز نشان داده شده است (Christiansen et al., 2018). بر خلاف BFR-RE کمبود استاندارد فشار در طی BFR-AE وجود دارد که باید در آینده برای بهینه سازی پاسخ ها و درک بیشتر از سازگاری عضلات در تمرین با BFR-AE بیشتر مطالعه شود.
پروتکل هایی برای جلوگیری از کاهش قدرت و آتروفی
در بخش زیر، مروری بر مقالات BFR با هدف کاهش از دست دادن قدرت عضلات اسکلتی و توده عضلانی ارائه خواهد شد.
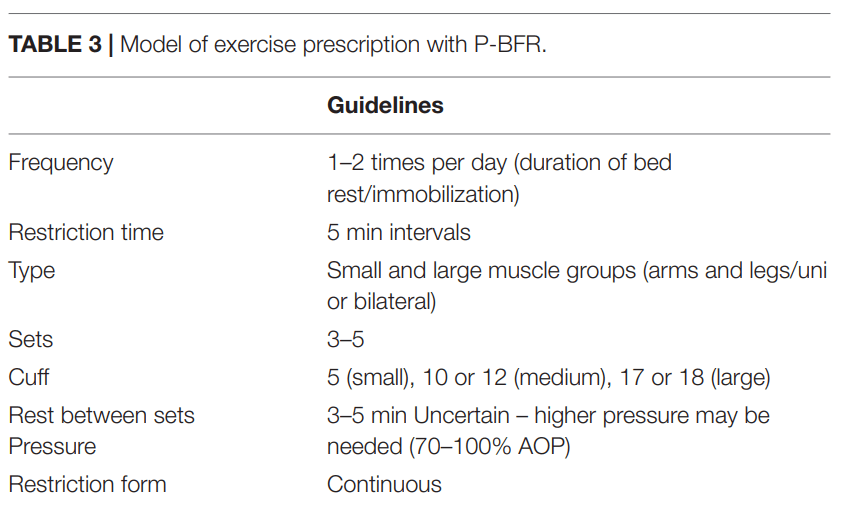
P-BFR
یک استراتژی دیگر برای استفاده از BFR شامل استفاده از کاف روی اندام ها بدون انجام ورزش (یعنی P-BFR) است. اگرچه این رویكردها مورد توجه تحقیقاتی قرار نگرفته اند، اما داده های موجود نشان می دهد كه استفاده متناوب از P-BFR ممكن است آتروفی عضلانی و كاهش قدرت را در طی دوره های استراحت در تخت یا بی حرکتی جبران كند (Takarada et al., 2000b; Kubota et al., 2008, 2011). این می تواند از نظر تئوری مزایایی را برای بیماران پس از جراحی های ارتوپدی مانند بازسازی رباط صلیبی قدامی (ACL) و آرتروپلاستی کامل زانو فراهم کند، زیرا در مرحله توانبخشی نیاز به توده عضلانی و قدرت کمتر است. P-BFR تکنیکی مشابه با روشی است که در طی پیش شرطی سازی کمبود خون (ischemia) یعنی دوره های کمبود خون و به دنبال آن دوره های خونرسانی مجدد انجام می شود. تا به امروز از این روش برای كاهش توده عضلانی و قدرت بعد از عمل جراحی ACL (Takarada et al., 2000b)، در حین بی حرکتی درون گچ (Kubota et al., 2008, 2011) و در بیماران تحت مراقبت های ویژه (Barbalho et al., 2018) استفاده شده است. بعلاوه، نشان داده شده است که P-BFR باعث افزایش قابلیت اکسید شدن عضلات اسکلتی موضعی و بهبودهای قلبی عروقی مانند افزایش گشاد شدن عروق وابسته به اندوتلیال (endothelial–dependent vasodilation) و هدایت عروقی (حدود 14 درصد) در کمتر از 7 روز می شود (Jones et al., 2014; Jeffries et al., 2018). مشاهدات مشابهی نیز در پی مواجهه متناوب طی 4 هفته (Kimura et al., 2007) و 8 هفته (Jones et al., 2015) انجام شده است.
تا به امروز، P-BFR به دنبال یک پروتکل استاندارد اجرا شده است که در ابتدا توسط Takarada et al. (2000b) توسعه یافته است. این پروتکل شامل 5 دقیقه محدودیت و به دنبال 3 دقیقه جریان خون مجدد برای 3-4 مجموعه اعمال می شود. محققان تاکنون این P-BFR را یک یا دو بار در روز و به مدت 1-8 هفته اجرا کرده اند (Takarada et al., 2000b; Kubota et al., 2008, 2011; Jones et al., 2014, 2015; Jeffries et al., 2018). باید اذعان کرد که مطالعات هنوز پروتکل های دیگر را با استفاده از مدت زمان مختلف BFR و خونرسانی مجدد یا تغییر نسبت زمان صرف شده با تورم کاف در مقابل نخلیه فشار آن بررسی نکرده اند. فشارهای مورد استفاده در طی P-BFR از 50 میلی متر جیوه (Kubota et al., 2011) تا 260 میلی متر جیوه در برخی از شرکت کنندگان متفاوت بوده است (Takarada et al., 2000b). در حال حاضر، هیچ فشار قطعی در منابع بررسی P-BFR تخصیص داده نشده است، اگرچه به نظر می رسد فشارهای نسبتاً زیاد ممکن است بیشترین اثرات محافظتی در مقابل عدم استفاده آتروفی ایجاد کننده انسداد کامل جریان مربوطه را ایجاد کنند (Takarada et al., 2000b; Kubota et al., 2008). بر خلاف تمرین BFR، استفاده از AOP در این بخش از تحقیقات رایج نبوده است. این احتمال وجود دارد که فشارهای زیاد مورد استفاده در برخی تحقیقات می تواند جریان خون از اندام و به اندام را به طور کامل متوقف کند، اما این امر به عوامل دیگری مانند کاف و اندازه اندام نیز بستگی دارد (Loenneke et al., 2012b).
BFR با تحریک الکتریکی (BFR-ES)
اخیراً شواهدی برای استفاده از BFR-ES به دست آمده است. تا به امروز شواهد بسیار کمی در این زمینه وجود دارد. Natsume et al. (2015) افزایش ضخامت و قدرت عضلانی را در یک دوره 2 هفته ای در شرکت کنندگان مرد آموزش دیده نشده پس از دو بار در روز BFR-ES نشان داد. به نظر می رسد شدت رابطهی دوز-پاسخ با سازگاری عضلانی داشته باشد، هنگامی که از یک شدت تحریک حداکثر قابل تحمل استفاده می شود افزایش قدرت قابل توجهی مشاهده می شود (Slysz and Burr, 2018) و ارتباطات مثبت بین شدت تمرین و افزایش قدرت (ضریب همبستگی 8/0) همچنین سطح مقطع الیاف سریع (r = 0.9) و آهسته (r = 0.7) (Natsume et al., 2018). بعلاوه، 6 هفته BFR-ES یک طرفه با شدت کم باعث افزایش CSA عضله کارپی دست به میزان 17 درصد بیشتر از ES به تنهایی در بازوی بیماران آسیب نخاعی شد (Gorgey et al., 2016). علاوه بر این، این بیماران همچنین عملکرد عروقی بهبود یافته را نشان می دهند، همانطور که با افزایش اتساع واسطه جریان (FMD) مشهود است. در حالی که BFR-ES یک مسیر جدید جالب در این زمینه است، قبل از ارائه توصیه های مبتنی بر شواهد برای پزشکان، تحقیقات بیشتری لازم است.
ایمنی
بخش های زیر جنبه های ایمنی که باید هنگام اجرای BFR در نظر گرفته شوند را ارائه می دهد.
پاسخ قلب و عروق به BFR-RE
در طول ورزش، افزایش تقاضای اکسیژن در عضلات اسکلتی فعال با پاسخ عروقی مرکزی و پیرامونی مطابقت دارد. ضربان قلب (HR) و میزان سکته مغزی (SV) میزان کل خروجی قلب (CO) را که توسط مقاومت عروقی توزیع می شود تعیین می کند (Hogan, 2009). مکانیسم های تنظیم کننده جریان خون (BF) شامل سیستم عصبی مرکزی (یعنی نوسان صدای احساسی) و بازخورد پیرامون ناشی از مکانیسم های منطقه ای (یعنی ونول ها و آرتریول ها) و محلی (یعنی بسترهای مویرگی) است (Murrant and Sarelius, 2015). کنترل موضعی آهنگ اعصاب کنترل کننده رگ ها به عوامل متابولیکی، مکانیکی و اندوتلیال (endothelial) بستگی دارد. پاسخ های یکپارچه افزایش فشار متابولیکی، فشرده سازی خارجی دیواره شریانی و تنش برشی اندوتلیوم، کنترل سمپاتیک اتونومی تن وازوموتور را محدود می کند و درنهایت منجر به سطح متعادلی از اتساع عروق در عضله فعال می شود که توزیع کافی CO را فراهم می کند (Saltin et al., 1998) و بررس ها نشان داده است که این عوامل تحت تأثیر BFR-RE می باشند (Mouser et al., 2017a; Credeur et al., 2010). منحصر به فرد بودن BFR-RE به دلیل فشار خارجی است که رگهای خونی و بافت نرم اطراف آن را فشرده می کند که می تواند واسطه یک پاسخ قلبی عروقی تغییر یافته باشد. از این پس، شواهدی از سازگاری عروقی مرکزی و پیرامونی کوتاه مدت و بلند مدت ارائه می شوند.
پاسخ عروق مرکزی به BFR-RE
اثر BFR-RE در پاسخ قلب و سیستم عروق مرکزی به سطح BFR (Rossow et al., 2012)، نحوه ورزش (یعنی، BFR-RE در مقابل BFR-AE ) (Staunton et al., 2015) و نحوه کاربرد (یعنی، پیوسته در مقابل BFR متناوب (Brandner et al., 2015; Neto et al., 2016) بستگی دارد. BFR زمانی که با RT (Takano et al., 2005; Rossow et al., 2011, 2012; Fahs et al., 2012; Vieira et al., 2013; Downs et al., 2014; Brandner et al., 2015; Staunton et al., 2015; Neto et al., 2016; Poton and Polito, 2016; Libardi et al., 2017; May et al., 2017)،AE (Renzi et al., 2010; Kumagai et al., 2012; Sugawara et al., 2015; Staunton et al., 2015; May et al., 2017) ترکیب شود یا حتی در غیاب ورزش (Iida et al., 2007) به شدت بر پارامترهای همودینامیکی (یعنی جریان خون درون اندام ها و بافت های بدن) مرکزی تأثیر می گذارد. در حالی که افزایش پاسخ قلب و عروق مرکزی در حین ورزش وجود دارد، که این حالت به سرعت (5-10 دقیقه) پس از ورزش به حالت پایه بر می گردد و قطع می شود.
مطالعاتی که فشار را در فواصل استراحت ادامه داده اند (BFR پیوسته) به طور کلی فشار خارجی اعمال شده بیشتری برای افزایشHR، SbP، فشار خون دیاستولیک (DbP) یا نتیجه دو برابر (HR × SbP) در مقایسه با همان تمرین در شرایط جریان آزاد را یافته اند (Takano et al., 2005; Renzi et al., 2010; Kumagai et al., 2012; Vieira et al., 2013; Poton and Polito, 2015; Sugawara et al., 2015; May et al., 2017). کارهای اخیر به طور بالقوه به این دلیل که فشار انسداد نسبت به AOP تنظیم شده بود، نتایج و شواهد مخالف را گزارش کرده اند (Neto et al., 2016; Libardi et al., 2017). به نظر می رسد خروجی سیستم قلبی در حین ورزش تحت تأثیر BFR قرار نمی گیرد، زیرا گروه های BFR نسبت به گروه های فاقد BFR به طور متناسب HR را افزایش و SV را کاهش می دهند (Takano et al., 2005; Renzi et al., 2010; Sugawara et al., 2015). به نظر می رسد حذف کاف BFR در فواصل استراحت (BFR متناوب) تفاوت قلبی عروقی بین ورزش BFR و غیر BFR را کاهش می دهد (Neto et al., 2016). مطالعات مربوط به برداشتن کاف بین ست ها یا بین تمرینات هیچ گونه تغییر دیگری در HR (Rossow et al., 2011; Fahs et al., 2012; Downs et al., 2014; Neto et al., 2016) SbP یا DbP(Rossow et al., 2011; Neto et al., 2016)، CO یا SV (Rossow et al., 2011; Downs et al., 2014) در گروه BFR در مقایسه با گروه غیر BFR نشان نداده اند.
تغییرات در پاسخ سیستم جریان خون مرکزی با بکارگیری BFR-RE در مقایسه با HL-RE کمتر است (Rossow et al., 2011; Fahs et al., 2012; Downs et al., 2014; Brandner et al., 2015; Poton and Polito, 2015; Libardi et al., 2017)، به ویژه اگر BFR با AE ترکیب شود (May et al., 2017). با این حال، شواهدی وجود دارد که تغییرات در جریان خارجی یا پیرامونی BFR هنگام پیاده روی سبک، فشار سیستولیک خارجی (11٪) و آئورت (43٪) را در مقایسه با ورزش مشابه بدون انسداد افزایش داده و تقویت می کند. جالب توجه است که به نظر می رسد این اثر به طور اساسی غیر مستقیم باشد زیرا BFR فقط بر امواج فشار خروجی و نه منعکس شده تأثیر می گذارد (Sugawara et al., 2015). نکته قابل توجه اینکه کنترل فشار بر پاسخ قلبی عروقی به BFR-RE تأثیر می گذارد. فشارهای محدود کننده نسبی بیشتر شامل پاسخ قلبی عروقی بیشتر به BFR-RE می شود (Rossow et al., 2012) و ممکن است خطر بالقوه مرتبط با BFR-RE را افزایش دهد. بعلاوه، اگر در فواصل استراحت کاف های فشار خارج نشوند،، BFR-RE می تواند فشار خون را در مقایسه با HL-RE بالا نگه دارد (Downs et al., 2014). از سوی دیگر، BFR-RE منجر به افت فشار خون بیشتر از HL-RE بعد از ورزش می شود (Domingos and Polito, 2018).
پاسخ خروجی (Peripheral) عروق به BFR-RE
نشان داده شده است که تمرین BFR بر اجابت و پاسخ شریانی و عملکرد اندوتلیال تأثیر می گذارد. پاسخ عروقی اغلب به دنبال BFR-RE آزمایش شده است (Credeur et al., 2010; Clark et al., 2011; Fahs et al., 2012; Hunt et al., 2012, 2013). Fahs et al. (2012) چهار مجموعه از چهار تمرین مختلف اندام تحتانی موثر بر پاسخ شریان بزرگ و کوچک را یافتند. BFR-RE اجابت شریان بزرگ را به همان اندازه LL-RE و HL-RE افزایش داد، در حالی که اجابت شریان کوچک بیشتر تحت تأثیر HL-RE بود و هیچ تفاوتی بین گروه های LL-RE و BFR-RE وجود نداشت. این یافته ها بهبود موقت عملکرد اندوتلیال بعد از BFR-RE را نشان می دهد. با این حال، به نظر نمی رسد که این پاسخ شدید مانع از ایجاد سازگاری طولانی مدت واکنش عروقی شود (Clark et al., 2011; Hunt et al., 2012, 2013) که در مقابل ممکن است تحت تأثیر شدت خیلی کم BFR-RE قرار گیرد (Credeur et al., 2010). سایر اشکال کاربرد محرک BFR در منابع کمتر مورد توجه قرار گرفته اند. نشان داده شده است که BFR-AE اتساع با واسطه (غیر مستقیم) جریان (FMD) را مختل می کند (Renzi et al., 2010)، در حالی که دیگران گزارش کرده اند که BFR-AE باعث افزایش FMD در طولانی مدت می شود (Iida et al., 2011).
مقاومت عروقی سیستمیک (SVR) به دلیل گشاد شدن عروق، در دسته ورزش عضلانی کاهش می یابد. تهدید فشار سیستمیک برای عدم رعایت تنظیمات تنظیم کننده جدید در حین ورزش با افزایش CO و شدت سمپاتیک اعصاب کنترل کننده رگ ها جبران می شود. عدم تطابق بین CO، کنترل سمپاتیک سیستم اعصاب کنترل کننده رگ ها و مکانیسم های محلی پرکاری فعال می تواند منجر به سنکوپ فشار خون پایین شود (Hogan, 2009). وقوع سنکوپ در منابع BFR-RE بطور مکرر گزارش نشده است (Nakajima et al., 2006)، اما به نظر می رسد این موارد در بین پزشکان و مراکز بالینی که خطر در هر موردی بیشتر است، بیشتر باشد (Patterson and Brandner, 2017). استفاده از BFR در صورت عدم وجود محرک دیگر، SVR را با کاهش همزمان CO افزایش می دهد (Iida et al., 2007). نشان داده است که SVR پس از BFR-RE افزایش یافته یا بدون تغییر باقی می ماندTakano et al., 2005; Rossow et al., 2011; Staunton et al., 2015; Libardi et al., 2017) (Renzi et al., 2010; Staunton et al., 2015 و بعد از ورزش کاهش می یابد (Fahs et al., 2012). اگرچه به نظر نمی رسد که رابطه بین CO و SVR تهدیدهای قلبی عروقی در ورزش BFR را نشان دهد، یک CO ثابت همراه با افزایش SVR می تواند باعث افزایش فشار خون شود و ممکن است پاسخ های جانبی منفی کنار گذاشته نشوند.
ترومبوآمبولی وریدی (Venous Thromboembolism)
لخته توده ای جامد از پلاکت، گلبول های قرمز و شبکه فیبرین است که به طور معمول به عنوان پاسخی به آسیب دیواره رگ تشکیل می شود و بخشی از آبشار طبیعی است (Furie and Furie, 2008). جمع شدن خون در دوره های گرفتگی یا سکون، که می تواند در طول بستری شدن در بیمارستان یا مسافرت طولانی مدت اتفاق بیفتد، می تواند تشکیل لخته را تحریک کند. لخته به اندازه کافی بزرگ برای جلوگیری از جریان خون، به خصوص اگر در رگ های کوچکتر واقع شود، می تواند منجر به کمبود خون در بافت موضعی و متعاقب آن مرگ بافت شود. در صورت که جابجا شود به آن آمبولی گفته می شود و می تواند منجر به آمبولی ریوی (PE ) شود که می تواند زندگی را تهدید کند (Heit, 2015). در مجموع، لخته ورید عمقی (DVT) و PE به عنوان ترومبوآمبولی وریدی (VTE) نامیده می شوند.
میزان بروز VTE سالانه 10 میلیون مورد تخمین زده شده است (Raskob et al., 2014). اروپای غربی، آمریکای شمالی، استرالیا و آمریکای لاتین جنوبی نتایج ثابت VTE را از 75/0 تا 69/2 در هر 1000 نفر در سال بیان کردند. این عارضه با افزایش سن، 2-7 در 1000 در افراد بالای 70 سال افزایش می یابد. میزان بروز در قومیت های چینی و کره ای کمتر است، با این حال، افزایش جمعیت ممکن است باعث افزایش فشار VTE شود (Raskob et al., 2014). چندین عامل خطر VTE شامل شرایط پزشکی مانند جراحی اصلی ارتوپدی، جراحی عمومی عمده، فلج اندام تحتانی به دلیل آسیب نخاعی، شکستگی لگن، مفصل ران یا استخوان بلند، پلی تروما و سرطان شناسایی شده است (Anderson and Spencer, 2003; Cionac Florescu et al., 2013). ساید عوامل خطر شامل سابقه VTE قبلی، چاقی، بی حرکتی، داروهای پیشگیری از بارداری خوراکی، سابقه خانوادگی VTE، عدم تحرک بدنی و شرایط ژنتیکی است که بر لخته شدن خون تأثیر می گذارد (Anderson and Spencer, 2003). بارداری خطر بالایی را در دوره های قبل و پس از زایمان به همراه دارد (Heit et al., 2005). ایجاد DVT در اندام تحتانی در مقایسه با اندام فوقانی بسیار معمول تر است، تقریباً 10٪ از وقوع DVT در اندام فوقانی دیده می شود (Kucher, 2011). در نهایت اینکه، قرار دادن کاتترهای (catheters ) مرکزی در طی مراحل پزشکی بیشترین عامل خطر را در تشکیلات ترومبوس اندام فوقانی تشکیل می دهد (Grant et al., 2012).
BFR-RE و ترومبوآمبولی وریدی: درجات حاد
یک نگرانی ذاتی در تشکیل DVT به دلیل فشرده سازی خارجی عروق از طریق یک کاف مسدود کننده در طول BFR-RE وجود دارد. در بسیاری از آزمایشات منتشر شده BFR-RE بطور مستقیم تشکیل VTE را اندازه گیری نمی کنند یا از تصویربرداری تشخیصی استفاده نمی کنند. با این حال، کل منابع نشان می دهد حداقل عوارض جانبی مربوط به VTE و حوادث بالینی گزارش نشده است.
بیشتر مطالعاتی که پس از استفاده از BFR-RE برای VTE ارزیابی شده اند، از مارکرهای مستقیم خون برای انعقاد استفاده کرده اند. مطالعات دقیق افزایش قابل توجهی در انعقاد خون از طریق D-dimer و مقادیر را پس از ورزش BFR-RE را نشان نداده اند، یکی از آزمایشات بالینی که بیشترین تست های کلینیکی استفاده شده برای رد رخ داد DVT را دارد (Nakajima et al., 2007; Fry et al., 2010; Madarame et al., 2010; Clark et al., 2011). مطالعه Madarame et al. (2013) شامل تست قطعه پروترومبین (PTF) و آزمایش ترومبین-آنتی ترومبینIII (TAT) برای ارزیابی افزایش تولید ترومبین بلافاصله پس از تمرین اجرا شد و هیچ افزایش قابل توجهی مشاهده نشد. علاوه بر این، پروتئین واکنش پذیرC (CRP)، پروتئینی که با تشکیل لخته ارتباط دارد، نیز در یک مطالعه ارزیابی شد و افزایش قابل توجهی مشاهده نشد (Clark et al., 2011). افرادی که BFR-RE را در ارتفاع شبیه سازی شده و ساختگی (8000 فوت) و در موقعیت 6 درجه ای سر به پایین انجام می دهند، افزایش قابل توجهی در D-dimer، محصول تخریب فیبرین (FDP ) یا مهارکننده فعال کننده پلاسمینوژن (PAI) نشان نمی دهند (Nakajima et al., 2007) ). فقط یک مطالعه نشانگرهای انعقاد خون را در یک جمعیت بالینی تشخیص داده است (Madarame et al., 2013). 9 نفر (7 مرد و 2 زن) با سابقه تایید شده از بیماری ایسکمیک (ischemic ) قلبی، کشش های دو طرفه تحتانی زانو را در 20٪ 1RM با یا بدون BFR انجام دادند. D-dimer، FDP و CRP قبل، بلافاصله بعد و دوباره 1 ساعت بعد از هر دو شرایط ورزشی ارزیابی شدند. D-dimer و CRP در هر دو شرایط BFR-RE و جریان آزاد به طور قابل توجهی افزایش یافت، با این حال، مقادیر در یک محدوده طبیعی بالینی باقی مانده است. پس از تنظیم حجم پلاسما (PV)، تغییرات در مقادیر هر گروه دیگر از نظر آماری افزایش پیدا نکرد. CRP افزایش غیر بالینی قابل توجه مشابه را نشان داد و پس از تنظیم PV معنی دار نبود. FDP در هر دو گروه از نظر آماری بالا نبود.
بیشتر مطالعات دقیق روی جمعیت سالم انجام شده است [4 سالم (Nakajima et al., 2007; Fry et al., 2010; Madarame et al., 2010; Clark et al., 2011) در مقابل 1 مورد کلینیکی (Madarame et al., 2013)]. علاوه بر این، ویژگی های جنسی به سمت مردان در مقابل افراد زن (38 مرد و 4 زن) گرایش پیدا کرده است، و همه فقط در اندام تحتانی انجام شده اند (Nakajima et al., 2007; Fry et al., 2010; Madarame et al., 2010, 2013; Clark et al., 2011). تمام مطالعات به غیر از یكی، كه BFR-RE را در 30٪ 1RM با 80٪ 1RM گروه كنترل جریان آزاد مقایسه كرد، از LL-RE در دو شرایط BFR-RE و جریان آزاد استفاده كرد (Clark et al., 2011). فشارهای استاندارد بین 150 تا 200 میلی متر جیوه در همه مطالعات استفاده شد (Nakajima et al., 2007; Fry et al., 2010; Madarame et al., 2010, 2013) به جز یک مطالعه که از فشار برابر 130 SBP استفاده کرد (Clark et al., 2011). مطالعات دقیق در آینده که فشارهای نسبی، اندام فوقانی، جمعیت بالینی و افراد زن را بررسی کنند، قابل توجیه است.
BFR-RE و ترومبوآمبولی وریدی: میزان مزمن
بیشترین کاربردهای BFR-RE در تنظیمات بالینی و تحقیقاتی به صورت شدید در طی هفته ها و ماه ها انجام می شود. چندین مقاله نگرانی های VTE را در یک مدل شدید (مزمن) بررسی کرده اند. پس از 4 هفته ورزش دو طرفه اندام تحتانی با 30٪ 1RM هیچ تغییری در D-dimer، فیبرینوژن یا CRP مشاهده نشد (Clark et al., 2011). به طور مشابه، 2 روز در هفته تمرین به مدت 12 هفته BFR-RE با 20-30٪ 1RM به طور قابل توجهیFDP، D-dimer یا کراتین کیناز (CK) را در افراد مسن (سنین 61-84 سال) افزایش نداد (Yasuda et al., 2015a). همین نویسندگان مشاهده کردند پس از 12 هفته تمرین دو طرفه آرنج و باند الاستیک خم شدن آرنج، هیچ افزایش قابل توجهی در سطحD-dimer، FDP یا CK رخ نداد (Yasuda et al., 2015b). BFR-RE شدی پس از جراحی زانو، طی 12 جلسه به مدت متوسط 6 هفته، هیچ نشانه ای از تشکیل ترومبوز را که توسط اسکن اولتراسوند دوبلکس اندازه گیری می شود، نشان نداد (Tennent et al., 2017). یک پرسشنامه اپیدمیولوژیک وسیع در ژاپن با بیش از 12000 نفر، میزان بروز ترومبوز وریدی را در 055/0 درصد و PE را در 008/0 درصد گزارش کرده است، توجه داشته باشید که یک تشخیص پزشکی واقعی برای PE تأیید نشده است (Nakajima et al., 2006). مقدار گزارش شده برای بروز DVT در این مطالعه کمتر از گزارش شده در جمعیت عمومی در آسیا (2/0 تا 26/0 درصد) است که خطر جمعیت بسیار کمی را بیان می کند (Klatsky et al., 2000).
چارچوب زمانی کل برای مطالعات حاد اندازه گیری پتانسیل VTE پس از BFR از 4 تا 12 هفته بیش از چهار مطالعه است. تعصب جنسیتی در مطالعات حاد با 35 مرد و 37 زن مورد آزمایش بسیار کمتر است. در یک مطالعه، از سونوگرافی داپلر برای شخصی سازی فشار کاف به 80٪ AOP در اندام تحتانی و کاف های گسترده استفاده شده است (5/11 سانتی متر ؛ Tennent et al., 2017). در سه مطالعه دیگر از بندهای باریک در اندام تحتانی (3-6 سانتی متر) و در دو مورد از فشار مطلق استاندارد با میانگین 196 ± 18 میلی متر جیوه استفاده شده است و برخی از 130٪ SbP استفاده می کند (Clark et al., 2011; Yasuda et al., 2015a,b).
BFR-RE و سیستم فیبرینولیتیک
لخته شدن در سیستم عروقی پس از آسیب بخشی از روند طبیعی بهبود است و مدت کوتاهی از گرفتگی می تواند بدون ایجاد عوارض جانبی، ساختار ترومبوس ایجاد کند. یک مکانیسم برای کنترل پیشرفت تشکیل ترومبوس از طریق تحریک سیستم فیبرینولیتیک است. تمرین مقاومت توانایی تنظیم مجدد مسیر فیبرینولیتیک را نشان داده و فقط پس از یک جلسه تمرین و در شرکت کنندگان جوان سالم و بیماران مسن با بیماری عروق کرونر (CAD) نشان داده شده است (El-Sayed, 1993; de Jong et al., 2006). به نظر می رسد که BFR-RE سیستم فیبرینولیتیک را تحریک می کند، زیرا BFR-RE اندام تحتانی باعث افزایش فعال کننده پلاسمینوژن بافتی (tPA، یک پروتئین تخریب کننده ترومبوس در سلول اپیتلیال) در شرکت کنندگان سالم می شود (Nakajima et al., 2007; Madarame et al., 2010). علاوه بر این، استفاده از انسداد عروقی بدون ورزش افزایش قابل توجهی در فاکتورهای فیبرینولیتیک را نشان داده است (Stegnar and Pentek, 1993; Nakajima et al., 2007). با این حال، متغیرهایی مانند سن، جنس و چاقی ممکن است پاسخ فیبرونولیتیک به ورزش را تغییر دهند (Stegnar and Pentek, 1993).
BFR-RE و جمعیت در معرض خطر برای VTE
عوامل خطر قابل شناسایی برای VTE مشخص شده اند که ترکیبی از خصوصیات درون زا مانند چاقی و عوامل ژنتیکی یا عوامل محرک برونزا مانند جراحی بزرگ یا بارداری است (Cushman, 2007). افزایش سن یک عامل خطر غیرقابل اصلاح برای بروز VTE است. پس از دهه چهارم زندگی، میزان بروز به سرعت از 1 در 10000 سالانه به 5-6 در 1000 در سال تا 80 سالگی افزایش می یابد (Silverstein et al., 1998). مطالعاتی که فاکتورهای انعقادی خون پس از BFR-RE، از جمله D-dimer، FDP و CK را بررسی می کنند، در افراد مسن اثرات مضر اثبات نکرده اند. سه مطالعه شامل افراد با دامنه سنی بین 61 تا 85 سال بوده و شامل آموزش BFR-RE اندام تحتانی و فوقانی است (Fry et al., 2010; Yasuda et al., 2015a,b). یک مطالعه به بررسی BFR-RE در یک جمعیت بالینی پیر (بیماری ایسکمیک قلب) پرداخته و افزایش فاکتورهای انعقاد خون را بیان نکرده است (Madarame et al., 2013). وضعیت انعقادی یک گروه عامل خطر دیگر پس از BFR-RE به طور مستقیم مطالعه نشده است. با این حال، آزمایشات بالینی BFR-RE در حال انجام در جمعیت های در معرض خطر (بیماران دیالیزی، شکستگی استخوان ران و آرتروپلاستی مفصل) ادامه دارد (Takano et al., 2013; ClinicalTrials.gov, 2016; Clarkson et al., 2017b). قوانین پیش بینی شده بالینی ایجاد شده برای ارزیابی احتمال VTE در افراد در معرض خطر می تواند قبل از استفاده از BFR-RE برای کمک به پزشکان و محققان در داوطلبان مناسب بکار گرفته شوند (Wells et al., 2000).
BFR-RE و گونه های واکنش پذیر اکسیژن
استرس اکسید کننده می تواند زمانی رخ دهد که تولید گونه های اکسیژن واکنش پذیر (ROS) بیش از توانایی سیستم آنتی اکسیدانی در کاهش مولکول ها باشد (Garten et al., 2015). کاهش تورم کاف با افزایش ROS همراه است و مستقیماً با آسیب های مجدد ایسکمیک خون رسانی پس از جراحی ارتوپدی همراه است (Cheng et al., 2003). بعلاوه، تمرینات مقاومتی می توانند باعث ایجاد ROS شوند (Reid and Durham, 2002; Rodriguez et al., 2003; Nikolaidis et al., 2007). قرار گرفتن متوسط در معرض ROS برای ایجاد مکانیسم های دفاعی آنتی اکسیدانی تطبیقی ضروری است، با این حال، قرار گرفتن در معرض مزمن یا زیاد با شرایط بیماری و علامت دهی سیستم انعقاد خون مرتبط است (Alfadda and Sallam, 2012; He et al., 2016).
مارکرهای خونی استرس اکسید کننده شامل کربونیل های پروتئین، پراکسیدهای لیپید و گلوتاتیون خون و همچنین سیستم های آنتی اکسیدان است. استفاده از BFR-RE (20% 1RM) در اندام تحتانی دو طرفه به طور قابل توجهی سطح پراکسید چربی را افزایش نمی دهد (Takarada et al., 2000a). هنگام مقایسه BFR، در ترکیب با LL-RE (30% of 1RM) و ورزش با مقاومت متوسط (70 درصد 1RM) فقط BFR و گروه های مقاومت متوسط افزایش کربونیل پروتئین و گلوتاتیون خون را نشان دادند (Goldfarb et al., 2008). به طور مشابه، BFR به تنهایی استرس اکسید کننده را افزایش می دهد اما علاوه بر این ورزش سطح پایین به BFR (30 درصد 1RM) به طور قابل توجهی کربونیل پروتئین و وضعیت گلوتاتیون را کاهش می دهد. علاوه بر این، به نظر نمی رسد یک دوره تمرین یا 1 هفته BFR-RE با فرکانس بالا (1-2 جلسه در روز / 3 هفته ؛ 20-30٪ -1RM) استرس اکسید کننده یا پاسخ آنزیم آنتی اکسیدانی را افزایش دهد (Nielsen et al., 2017a; Centner et al., 2018b). با این حال، ورزش با شدت متوسط(70 درصد 1RM) با یا بدون BFR هر دو استرس اکسید کننده را به طور قابل توجهی افزایش می دهند (Garten et al., 2015). بنابراین، به نظر نمی رسد که به طور کلی افزودن BFR به LL-RE باعث افزایش استرس اکسید کننده یا دفاع آنتی اکسیدانی شود، بنابراین ممکن است تشکیل استرس اکسید کننده بار باشد، نه اینکه به BFR وابسته باشد. کار بیشتر برای درک تأثیر ورزش BFR در پاسخهای استرس اکسید کننده، و اثر بالقوه برای این که به عنوان یک محرک برای سازگاری عمل کند، مورد نیاز است.
آسیب عضلانی.
HL-RE معمول می تواند آسیب عضلانی ایجاد کند به ویژه در کسانی که ورزش نمی کنند (Damas et al., 2016). این آسیب می تواند توسط مارکرهای مستقیم و غیر مستقیم ثبت شود و اغلب با مرحله خارج از مرکز تمرین همراه و مرتبط است (Nosaka and Newton, 2002). تصور می شود که پاسخ اولیه آسیب به دلیل کشش بیش از حد سارکومر در نتیجه جریان خط Z و همچنین اختلال در نهایت ماتریس سیتواسکلتال رخ دهد (Proske and Morgan, 2001). آسیب عضلانی همچنین ممکن است منجر به فعال شدن کانال های کلسیم فعال شده در کشش یا کانال های بالقوه گیرنده گذرا شود که می تواند کلسیم داخل سلولی را افزایش دهد که می تواند منجر به تخریب پروتئین های سارکومریک از طریق فعال شدن کالپین شود (Allen et al., 2005; Yeung et al., 2005). پس از آسیب اولیه، اغلب یک آسیب ثانویه ایجاد می شود که ناشی از پاسخ التهابی است (Pizza et al., 2002). با توجه به این تأثیرات، آسیب به عضله می تواند مستقیماً از طریق مطالعه و بافت برداری عضله مشخص شود، یا می تواند به طور غیرمستقیم از طریق تعیین کمیت علائم مربوط به عضله آسیب دیده، استنباط شود (Clarkson et al., 1986). این نشانگرها شامل کاهش تولید نیرو، کاهش دامنه حرکتی، درد عضلانی، ورم و با اندازه گیری سطح گردش خون CK و یا میوگلوبین است.
در موارد شدید، ورزش می تواند با تجزیه بافت عضله اسکلتی خط دار همراه باشد، اصطلاحا رابدومیولیز فشاری، که می تواند منجر به درد ثانویه، تورم و آسیب احتمالی اندام انتهایی شود (Tietze and Borchers, 2014). موارد رابدوميوليزم فشاری معمولاً با يك بار تمريني همراه است كه تا حد زيادي از تناسب اندام و فعاليت بدني طبيعي بيشتر است، اما همچنين با بارهاي حرارتي زياد، كم آبي بدن يا استفاده از برخي داروها همراه بوده است (Zimmerman and Shen, 2013). گفته شده است که ممکن است خطر بسیار بالای رابدومیولیز در نتیجه تمرین BFR که در آن استرس متابولیکی با وجود استفاده از بارهای کم، بزرگ می شود، رخ دهد. در واقع، تعدادی گزارشات وجود دارد که رابدمیولیز از طریق استفاده از BFR-RE اتفاق می افتد (Iversen and Rstad, 2010; Clark and Manini, 2016; Tabata et al., 2016)، با این حال، تجزیه و تحلیل میزان بروز از منابع منتشر شده نشان می دهد که خطر بسیار کم باقی می ماند (07/0 تا 2/0 درصد) (Thompson et al., 2018). نتایج نظرسنجی در ژاپن، جایی که تمرین کاتاتسو توسط تعداد بیشتری از افراد تمرین شده است، به طور مشابه، بروز کم 008/0 را نشان می دهد (Nakajima et al., 2006). بنابراین، با وجود این که رابدومیولیز فشاری در حین ورزش BFR امکان پذیر است، اما در حال حاضر شواهد نشان نمی دهد که خطر در مقایسه با ورزش سنتی زیاد می شود.
یک نگرانی رایج در مورد استفاده از BFR با یا بدون ورزش این است که این محرک ممکن است منجر به آسیب عضلانی یا حتی افزایش آن از طریق آسیب ایسکمیک مجدد جریان خون شود.
اگرچه آسیب ایسکمی-پرفیوژن مجدد معمولاً با طول مدت طولانی ایسکمی شدید در ارتباط است (Blaisdell, 2002)، این امکان وجود دارد که ترکیبی از BFR کوتاه مدت با انقباض عضلانی بتواند با این نوع ورزش احتمال آسیب عضلانی را افزایش دهد. پاسخ آسیب عضلانی ناشی از ورزش در BFR در قسمت فوقانی و تحتانی بدن مورد بررسی قرار گرفته است (Loenneke et al., 2014a). درد عضلانی، نشانگر غیرمستقیم آسیب عضلانی، در روزهای پس از LL-RE در ترکیب با BFR مرتباً بالاتر از سطح پایه است (Umbel et al., 2009; Wernbom et al., 2012; Thiebaud et al., 2013; Wilson et al., 2013; Sieljacks et al., 2016; Nielsen et al., 2017a). اغلب بلافاصله پس از ورزش کاهش زیادی در تولید حداکثر نیروی گشتاور مشاهده می شود، با این حال، اکثر مطالعات نشان می دهند که نیروی گشتاور در روزهای بعد به پایه یا نزدیک به آن باز می گردد (Umbel et al., 2009; Wernbom et al., 2012; Thiebaud et al., 2013; Loenneke et al., 2014a). تورم عضله بلافاصله بعد از ورزش بطور مداورم افزایش می یابد، اما این تورم با گذشت زمان کاهش می یابد و اغلب 24 تا 48 ساعت بعد به حالت اولیه باز می گردد (Thiebaud et al., 2013; Farup et al., 2015). بعلاوه، چند مطالعه که در زمینه تغییرات دامنه حرکتی انجام شدند، هیچ تفاوتی در طول مدت زمان نشان ندادند (Thiebaud et al., 2013, 2014). در حالی که برخی مطالعات کاهش طولانی مدت نیروی گشتاور و تورم طولانی مدت را گزارش کرده اند، اما این تغییرات معمولاً با کنترل همسان تکررا بدون BFR متفاوت نیستند (Umbel et al., 2009; Wernbom et al., 2012) که نشان می دهد این تغییرات نتیجه LL-RE هستند نه استفاده از BFR. اگرچه CK و میوگلوبین اغلب در مطالعات طراحی شده برای ارزیابی دوره بهبودی عضلات اندازه گیری نمی شوند، اکثر مطالعات تغییری در روزهای بعد از ورزش یا تمرین گزارش نمی کنند (Abe et al., 2006; Yasuda et al., 2015a; Nielsen et al., 2017a). قابل ذکر است که اخیرا یک مطالعه کاهش طولانی مدت نیروی گشتاور، تورم و افزایش پروتئین های خون (CK و میوگلوبین) را در طی 5 ست تمرین محدودیت جریان خون به شکست ارادی مشاهده کرده است (Sieljacks et al., 2016). در همین راستا، استفاده از یک پروتکل مکرر زیاد (1-2 جلسه در روز) برای 2 دوره 5 روز تمرین متوالی که با 10 روز استراحت در هم آمیخته اند اخیراً افزایش سطح CK در طی و کاهش تولید گشتاور پس از 5 روز اول را نشان داده است (Bjornsen et al., 2018) مخصوصا زمانی که این پروتکل ها با یک دوره تمرین بعدی 10-14 روز دنبال می شد، حداقل تغییرات اساسی وجود داشت که نشان می دهد که ممکن است اثر یک دوره تکرار شونده با این نوع ورزش موجود داشته باشد (Sieljacks et al., 2016; Bjornsen et al., 2018). با این حال، دو مطالعه با استفاده از یک پروتکل مکرر شدید (1-2 جلسه در روز) برای 10-15 روز تمرین، سازگاری مکانیکی عضله با تأخیر (12-20 روز پس از مداخله) را احتمالاً به عنوان یک نتیجه از استرس طولانی مدت سلول نشان داده است (Nielsen et al., 2017a; Bjornsen et al., 2018). از نظر ما، فقط دو مطالعه آسیب مستقیم در سطح فیبر را بررسی کرده و گزارش کرده اند که اگرچه نشانه هایی از استرس وجود دارد، اما به نظر می رسد که هیچ آسیبی واقعی به عضله واقعی وارد نشده است یا بسیار جزئی است (Cumming et al., 2014; Nielsen et al., 2017a).
به طور خلاصه، شواهد موجود نشان می دهد که به نظر نمی رسد استفاده از BFR باعث ایجاد آسیب عضلانی به LL-RE با استفاده از یک پروتکل های تمرینی حداکثر در 5 ست باعث بروز نارسایی عمدی شود. ممکن است افرادی وجود داشته باشند که بیشتر از سایرین مستعد آسیب عضلانی باشند، با این وجود به نظر می رسد این امر بیشتر از تفاوت های ذاتی فرد نسبت به کاربرد BFR باشد. با این وجود،راحتی و روش فرد در برنامه ورزشی ضمن مستند کردن نشانگرهای غیرمستقیم آسیب عضلانی، می تواند به شناسایی بهتر افرادی که بیشتر در معرض آسیب عضلانی هستند کمک کند و به پزشک کمک کند تا خطررانه تنها در مورد BFR بلکه به طور کلی کاهش دهد. تا کنون، یک مطالعه ای که آسیب دیدگی را بیان کرده است (Sieljacks et al., 2016)، تضعیف شدید با نشانگرهای غیرمستقیم آسیب عضلانی را در پاسخ به تمرین بعدی مشاهده کرده است. اکثر مطالعات بررسی آسیب عضلانی فشار مشابهی را به هر فرد وارد کرده اند بنابراین در حال حاضر مشخص نیست که اعمال فشار نسبی (به عنوان مثال، درصد انسداد اندام) چه تاثیری بر این پاسخ دارد. علاوه بر این، بیشتر مطالعات دوره زمانی آسیب عضلانی پس از یک تمرین ورزشی مقاومتی در برابر بار کم طراحی کرده اند. بنابراین، اطلاعات کمی در مورد اینکه چگونه این دوره زمانی تحت تأثیر دوره های اضافی ورزش مقاومتی در همان هفته تحت تأثیر قرار می گیرد، در دسترس است، با این حال، شواهد فعلی نشان می دهد که 1 یا 3 هفته تمرین شدید BFR با تکرار زیاد (1-2 جلسه در هفته) انجام شود باعث آسیب قابل مشاهده سلولی در افراد فعال مفرح نشود (Nielsen et al., 2017a). در نهایت، اگرچه شواهدی وجود دارد که نشان می دهد تمرین هوازی با شدت کم در ترکیب با BFR برای افزایش سازگاری های عضلانی در طول زمان مفید است، اما در حال حاضر مشخص نیست که آیا آسیبی در پاسخ به این روش ورزش وجود دارد یا خیر.
نتیجه گیری
هدف این مقاله ارائه یک مرور کلی از سازگاری با حالتهای مختلف BFR، روشهای کاربرد و ملاحظات ایمنی بود. نویسندگان با توجه به حجم و شدت، و همچنین میزان فشار کاف، زمان محدودیت، اندازه و مواد کاف استفاده از BFR همراه با اشکال مختلف ورزش (مقاوم، هوازی، غیر فعال) را توصیه می کنند. در جداول 1-3 پارامترهایی ارائه شده است که پزشکان باید از BFR براساس تحقیقات به روز و فعلی در منطقه استفاده کنند.
منابع
Abe, T., Beekley, M. D., Hinata, S., Koizumi, K., and Sato, Y. (2005a). Day-to-day change in muscle strength and MRI-measured skeletal muscle size during 7 days KAATSU resistance training: a case study. Int. J. KAATSU Train. Res. 1, 71–76. doi: 10.3806/ijktr.1.71
Abe, T., Kawamoto, K., Yasuda, T., Kearns, C. F., Midorikawa, T., and Sato, Y. (2005b). Eight days KAATSU-resistance training improved sprint but not jump performance in collegiate male track and field athletes. Int. J. KAATSU Train. Res. 1, 19–23. doi: 10.3806/ijktr.1.19
Abe, T., Yasuda, T., Midorikawa, T., Sato, Y., Kearns, C. F., Inoue, K., et al. (2005c). Skeletal muscle size and circulating IGF-1 are increased after two weeks of twice daily “KAATSU” resistance training. Int. J. KAATSU Train. Res. 1, 6–12. doi: 10.3806/ijktr.1.6
Abe, T., Kearns, C. F., and Sato, Y. (2006). Muscle size and strength are increased following walk training with restricted venous blood flow from the leg muscle, KAATSU-walk training. J. Appl. Physiol. 100, 1460–1466. doi: 10.1152/japplphysiol.01267.2005
Abe, T., Fujita, S., Nakajima, T., Sakamaki, M., Ozaki, H., Ogasawara, R., et al. (2010a). Effects of low-intensity cycle training with restricted leg blood flow on thigh muscle volume and VO 2max in young men. J. Sports Sci. Med. 9, 452–458.
Abe, T., Sakamaki, M., Fujita, S., Ozaki, H., Sugaya, M., Sato, Y., et al. (2010b). Effects of low-intensity walk training with restricted leg blood flow on muscle strength and aerobic capacity in older adults. J. Geriatr. Phys. Ther. 33, 34–40.
Alfadda, A. A., and Sallam, R. M. (2012). Reactive oxygen species in health and disease. J. Biomed. Biotechnol. 2012:936486. doi: 10.1155/2012/936486
Allen, D. G., Whitehead, N. P., and Yeung, E. W. (2005). Mechanisms of stretch-induced muscle damage in normal and dystrophic muscle: role of ionic changes. J. Physiol. 567(Pt 3), 723–735. doi: 10.1113/jphysiol.2005.091694
Anderson, F. A., and Spencer, F. A. (2003). Risk factors for venous thromboembolism. Circulation 107(23 Suppl. 1), I9–I16.
Barbalho, M., Rocha, A. C., Seus, T. L., Raiol, R., Del Vecchio, F. B., and Coswig, V. S. (2018). Addition of blood flow restriction to passive mobilization reduces the rate of muscle wasting in elderly patients in the intensive care unit: a within-patient randomized trial. Clin. Rehabil. 33, 233–240. doi: 10.1177/0269215518801440
Bjornsen, T., Wernbom, M., Lovstad, A. T., Paulsen, G., DSouza, R. F., Cameron-Smith, D., et al. (2018). Delayed myonuclear addition, myofiber hypertrophy, and increases in strength with high-frequency low-load blood flow restricted training to volitional failure. J. Appl. Physiol. 126, 578–592. doi: 10.1152/japplphysiol.00397.2018
Blaisdell, F. W. (2002). The pathophysiology of skeletal muscle ischemia and the reperfusion syndrome: a review. Cardiovasc. Surg. 10, 620–630. doi: 10.1016/s0967-2109(02)00070-4
Blazevich, A. J., Gill, N. D., Deans, N., and Zhou, S. (2017). Lack of human muscle architectural adaptation after short-term strength training. Muscle Nerve 35, 78–86. doi: 10.1002/mus.20666
Brandner, C. R., Kidgell, D. J., and Warmington, S. A. (2015). Unilateral bicep curl hemodynamics: low-pressure continuous vs high-pressure intermittent blood flow restriction. Scand. J. Med. Sci. Sports 25, 770–777. doi: 10.1111/sms.12297
Buckner, S. L., Dankel, S. J., Counts, B. R., Jessee, M. B., Mouser, J. G., Mattocks, K. T., et al. (2017). Influence of cuff material on blood flow restriction stimulus in the upper body. J. Physiol. Sci. 67, 207–215. doi: 10.1007/s12576-016-0457-0
Burgomaster, K. A., Moore, D. R., Schofield, L. M., Phillips, S. M., Sale, D. G., and Gibala, M. J. (2003). Resistance training with vascular occlusion: metabolic adaptations in human muscle. Med. Sci. Sports Exerc. 35, 1203–1208. doi: 10.1249/01.mss.0000074458.71025.71
Centner, C., Wiegel, P., Gollhofer, A., and König, D. (2018a). Effects of blood flow restriction training on muscular strength and hypertrophy in older individuals: a systematic review and meta-analysis. Sports Med. 49, 95–108. doi: 10.1007/s40279-018-0994-1
Centner, C., Zdzieblik, D., Dressler, P., Fink, B., Gollhofer, A., and Konig, D. (2018b). Acute effects of blood flow restriction on exercise-induced free radical production in young and healthy subjects. Free Radic. Res. 52, 446–454. doi: 10.1080/10715762.2018.1440293
Cheng, Y.-J., Chien, C. T., and Chen, C. F. (2003). Oxidative stress in bilateral total knee replacement, under ischaemic tourniquet. Bone Joint J. 85, 679–682. doi: 10.1302/0301-620x.85b5.13539
Christiansen, D., Murphy, R. M., Bangsbo, J., Stathis, C. G., and Bishop, D. J. (2018). Increased FXYD1 and PGC-1α mRNA after blood flow-restricted running is related to fibre type-specific AMPK signalling and oxidative stress in human muscle. Acta Physiol. 223:e13045. doi: 10.1111/apha.13045
Cionac Florescu, S., Anastase, D. M., Munteanu, A. M., Stoica, I. C., and Antonescu, D. (2013). Venous thromboembolism following major orthopedic surgery. Maedica 8, 189–194.
Clark, B. C., and Manini, T. M. (2016). Can KAATSU exercise cause rhabdomyolysis? Clin. J. Sport Med. 27, e1–e2. doi: 10.1097/JSM.0000000000000309
Clark, B. C., Manini, T. M., Hoffman, R. L., Williams, P. S., Guiler, M. K., Knutson, M. J., et al. (2011). Relative safety of 4 weeks of blood flow-restricted resistance exercise in young, healthy adults. Scand. J. Med. Sci. Sports 21, 653–662. doi: 10.1111/j.1600-0838.2010.01100.x
Clarkson, M. J., Conway, L., and Warmington, S. A. (2017a). Blood flow restriction walking and physical function in older adults: a randomized control trial. J. Sci. Med. Sport 20, 1041–1046. doi: 10.1016/j.jsams.2017.04.012
Clarkson, M. J., Fraser, S. F., Bennett, P. N., McMahon, L. P., Brumby, C., and Warmington, S. A. (2017b). Efficacy of blood flow restriction exercise during dialysis for end stage kidney disease patients: protocol of a randomised controlled trial. BMC Nephrol. 18:294. doi: 10.1186/s12882-017-0713-4
Clarkson, P. M., Byrnes, W. C., McCormick, K. M., Turcotte, L. P., and White, J. S. (1986). Muscle soreness and serum creatine kinase activity following isometric, eccentric, and concentric exercise. Int. J. Sports Med. 7, 152–155. doi: 10.1055/s-2008-1025753
ClinicalTrials.gov (2016). Identifier NCT027633488, Blood Flow Restriction Training Following Total Knee Arthroplasty; 2016 June 14). Bethesda, MD: National Library of Medicine.
Conceição, M. S., Junior, E. M. M., Telles, G. D., Libardi, C. A., Castro, A., Andrade, A. L. L., et al. (2019). Augmented anabolic responses after 8-wk cycling with blood flow restriction. Med. Sci. Sports Exerc. 51, 84–93. doi: 10.1249/MSS.0000000000001755
Cook, S. B., Clark, B. C., and Ploutz-Snyder, L. L. (2007). Effects of exercise load and blood-flow restriction on skeletal muscle function. Med. Sci. Sports Exerc. 39, 1708–1713. doi: 10.1249/mss.0b013e31812383d6
Cook, S. B., LaRoche, D. P., Villa, M. R., Barile, H., and Manini, T. M. (2017). Blood flow restricted resistance training in older adults at risk of mobility limitations. Exp. Gerontol. 99, 138–145. doi: 10.1016/j.exger.2017.10.004
Cook, S. B., Murphy, B. G., and Labarbera, K. E. (2013). Neuromuscular function after a bout of low-load blood flow-restricted exercise. Med. Sci. Sports Exerc. 45, 67–74. doi: 10.1249/MSS.0b013e31826c6fa8
Counts, B. R., Dankel, S. J., Barnett, B. E., Kim, D., Mouser, J. G., Allen, K. M., et al. (2016). Influence of relative blood flow restriction pressure on muscle activation and muscle adaptation. Muscle Nerve 53, 438–445. doi: 10.1002/mus.24756
Credeur, D. P., Hollis, B. C., and Welsch, M. A. (2010). Effects of handgrip training with venous restriction on brachial artery vasodilation. Med. Sci. Sports Exerc. 42, 1296–1302. doi: 10.1249/MSS.0b013e3181ca7b06
Crenshaw, A. G., Hargens, A. R., Gershuni, D. H., and Rydevik, B. (1988). Wide tourniquet cuffs more effective at lower inflation pressures. Acta Orthop. Scand. 59, 447–451. doi: 10.3109/17453678809149401
Cumming, K. T., Paulsen, G., Wernbom, M., Ugelstad, I., and Raastad, T. (2014). Acute response and subcellular movement of HSP27, alphaB-crystallin and HSP70 in human skeletal muscle after blood-flow-restricted low-load resistance exercise. Acta Physiol. 211, 634–646. doi: 10.1111/apha.12305
Cushman, M. (2007). Epidemiology and risk factors for venous thrombosis. Semin. Hematol. 44, 62–69. doi: 10.1053/j.seminhematol.2007.02.004
Damas, F., Phillips, S. M., Lixandrão, M. E., Vechin, F. C., Libardi, C. A., Roschel, H., et al. (2016). Early resistance training-induced increases in muscle cross-sectional area are concomitant with edema-induced muscle swelling. Eur. J. Appl. Physiol. 116, 49–56. doi: 10.1007/s00421-015-3243-4
Dankel, S. J., Jessee, M. B., Abe, T., and Loenneke, J. P. (2016). The effects of blood flow restriction on upper-body musculature located distal and proximal to applied pressure. Sports Med. 46, 23–33. doi: 10.1007/s40279-015-0407-7
de Jong, A. T., Womack, C. J., Perrine, J. A., and Franklin, B. A. (2006). Hemostatic responses to resistance training in patients with coronary artery disease. J. Cardiopulm. Rehabil. 26, 80–83. doi: 10.1097/00008483-200603000-00005
de Oliveira, M. F. M., Caputo, F., Corvino, R. B., and Denadai, B. S. (2016). Short-term low-intensity blood flow restricted interval training improves both aerobic fitness and muscle strength. Scand. J. Med. Sci. Sports 26, 1017–1025. doi: 10.1111/sms.12540
Domingos, E., and Polito, M. D. (2018). Blood pressure response between resistance exercise with and without blood flow restriction: a systematic review and meta-analysis. Life Sci. 209, 122–131. doi: 10.1016/j.lfs.2018.08.006
Downs, M. E., Hackney, K. J., Martin, D., Caine, T. L., Cunningham, D., O’Connor, D. P., et al. (2014). Acute vascular and cardiovascular responses to blood flow-restricted exercise. Med. Sci. Sports Exerc. 46, 1489–1497. doi: 10.1249/MSS.0000000000000253
Ellefsen, S., Hammarstrom, D., Strand, T. A., Zacharoff, E., Whist, J. E., Rauk, I., et al. (2015). Blood flow-restricted strength training displays high functional and biological efficacy in women: a within-subject comparison with high-load strength training. Am. J. Physiol. Regul. Integr. Comp. Physiol. 309, R767–R779. doi: 10.1152/ajpregu.00497.2014
El-Sayed, M. S. (1993). Fibrinolytic and hemostatic parameter response after resistance exercise. Med. Sci. Sports Exerc. 25, 597–602.
Fahs, C. A., Loenneke, J. P., Thiebaud, R. S., Rossow, L. M., Kim, D., Abe, T., et al. (2015). Muscular adaptations to fatiguing exercise with and without blood flow restriction. Clin. Physiol. Funct. Imaging 35, 167–176. doi: 10.1111/cpf.12141
Fahs, C. A., Rossow, L. M., Loenneke, J. P., Thiebaud, R. S., Kim, D., Bemben, D. A., et al. (2012). Effect of different types of lower body resistance training on arterial compliance and calf blood flow. Clin. Physiol. Funct. Imaging 32, 45–51. doi: 10.1111/j.1475-097X.2011.01053.x
Farup, J., de Paoli, F., Bjerg, K., Riis, S., Ringgard, S., and Vissing, K. (2015). Blood flow restricted and traditional resistance training performed to fatigue produce equal muscle hypertrophy. Scand. J. Med. Sci. Sports 25, 754–763. doi: 10.1111/sms.12396
Fleck, S. J., and Kraemer, W. J. (2004). Designing Resistance Training Programs, 3rd Edn. Champaign, IL: Human Kinetics.
Fry, C. S., Glynn, E. L., Drummond, M. J., Timmerman, K. L., Fujita, S., Abe, T., et al. (2010). Blood flow restriction exercise stimulates mTORC1 signaling and muscle protein synthesis in older men. J. Appl. Physiol. 108, 1199–1209. doi: 10.1152/japplphysiol.01266.2009
Fujita, T., Brechue, W., Kurita, K., Sato, Y., and Abe, T. (2008). Increased muscle volume and strength following six days of low-intensity resistance training with restricted muscle blood flow. Int. J. KAATSU Train. Res. 4, 1–8. doi: 10.3806/ijktr.4.1
Furie, B., and Furie, C. (2008). Mechanisms of thrombus formation. N. Engl. J. Med. 359, 938–949. doi: 10.1056/nejmra0801082
Garten, R. S., Goldfarb, A., Crabb, B., and Waller, J. (2015). The impact of partial vascular occlusion on oxidative stress markers during resistance exercise. Int. J. Sports Med. 36, 542–549. doi: 10.1055/s-0034-1396827
Goldfarb, A. H., Garten, R. S., Chee, P. D., Cho, C., Reeves, G. V., Hollander, D. B., et al. (2008). Resistance exercise effects on blood glutathione status and plasma protein carbonyls: influence of partial vascular occlusion. Eur. J. Appl. Physiol. 104, 813–819. doi: 10.1007/s00421-008-0836-1
Gorgey, A. S., Timmons, M. K., Dolbow, D. R., Bengel, J., Fugate-Laus, K. C., Michener, L. A., et al. (2016). Electrical stimulation and blood flow restriction increase wrist extensor cross-sectional area and flow meditated dilatation following spinal cord injury. Eur. J. Appl. Physiol. 116, 1231–1244. doi: 10.1007/s00421-016-3385-z
Grant, J. D., Stevens, S. M., Woller, S. C., Lee, E. W., Kee, S. T., Liu, D. M., et al. (2012). Diagnosis and management of upper extremity deep-vein thrombosis in adults. Thromb. Haemost. 108, 1097–1108. doi: 10.1160/TH12-05-0352
He, F., Li, J., Liu, Z., Chuang, C. C., Yang, W., and Zuo, L. (2016). Redox mechanism of reactive oxygen species in exercise. Front. Physiol. 7:486. doi: 10.3389/fphys.2016.00486
Heit, J. A. (2015). Epidemiology of venous thromboembolism. Nat. Rev. Cardiol. 12, 464–474. doi: 10.1038/nrcardio.2015.83
Heit, J. A., Kobbervig, C. E., James, A. H., Petterson, T. M., Bailey, K. R., and Melton, L. J. III (2005). Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30-year population-based study. Ann. Intern. Med. 143, 697–706.
Hogan, T. S. (2009). Exercise-induced reduction in systemic vascular resistance: a covert killer and an unrecognised resuscitation challenge? Med. Hypotheses 73, 479–484. doi: 10.1016/j.mehy.2009.06.021
Hughes, L., Paton, B., Rosenblatt, B., Gissane, C., and Patterson, S. D. (2017). Blood flow restriction training in clinical musculoskeletal rehabilitation: a systematic review and meta-analysis. Br. J. Sports Med. 51, 1003–1011. doi: 10.1136/bjsports-2016-097071
Hunt, J. E., Galea, D., Tufft, G., Bunce, D., and Ferguson, R. A. (2013). Time course of regional vascular adaptations to low load resistance training with blood flow restriction. J. Appl. Physiol. 115, 403–411. doi: 10.1152/japplphysiol.00040.2013
Hunt, J. E., Walton, L. A., and Ferguson, R. A. (2012). Brachial artery modifications to blood flow-restricted handgrip training and detraining. J. Appl. Physiol. 112, 956–961. doi: 10.1152/japplphysiol.00905.2011
Iida, H., Kurano, M., Takano, H., Kubota, N., Morita, T., Meguro, K., et al. (2007). Hemodynamic and neurohumoral responses to the restriction of femoral blood flow by KAATSU in healthy subjects. Eur. J. Appl. Physiol. 100, 275–285. doi: 10.1007/s00421-007-0430-y
Iida, H., Nakajima, T., Kurano, M., Yasuda, T., Sakamaki, M., Sato, Y., et al. (2011). Effects of walking with blood flow restriction on limb venous compliance in elderly subjects. Clin. Physiol. Funct. Imaging 31, 472–476. doi: 10.1111/j.1475-097X.2011.01044.x
Iversen, E., and Rstad, V. (2010). Low-load ischemic exercise-induced rhabdomyolysis. Clin. J. Sport Med. 20, 218–219. doi: 10.1097/jsm.0b013e3181df8d10
Jeffries, O., Waldron, M., Pattison, J. R., and Patterson, S. D. (2018). Enhanced local skeletal muscle oxidative capacity and microvascular blood flow following 7-day ischemic preconditioning in healthy humans. Front. Physiol. 9:463. doi: 10.3389/fphys.2018.00463
Jessee, M. B., Buckner, S. L., Dankel, S. J., Counts, B. R., Abe, T., and Loenneke, J. P. (2016). The influence of cuff width, sex, and race on arterial occlusion: implications for blood flow restriction research. Sports Med. 46, 913–921. doi: 10.1007/s40279-016-0473-5
Jessee, M. B., Dankel, S. J., Buckner, S. L., Mouser, J. G., Mattocks, K. T., and Loenneke, J. P. (2017). The cardiovascular and perceptual response to very low load blood flow restricted exercise. Int. J. Sports Med. 38, 597–603. doi: 10.1055/s-0043-109555
Jones, H., Hopkins, N., Bailey, T. G., Green, D. J., Cable, N. T., and Thijssen, D. H. (2014). Seven-day remote ischemic preconditioning improves local and systemic endothelial function and microcirculation in healthy humans. Am. J. Hypertens. 27, 918–925. doi: 10.1093/ajh/hpu004
Jones, H., Nyakayiru, J., Bailey, T. G., Green, D. J., Cable, N. T., Sprung, V. S., et al. (2015). Impact of eight weeks of repeated ischaemic preconditioning on brachial artery and cutaneous microcirculatory function in healthy males. Eur. J. Prev. Cardiol. 22, 1083–1087. doi: 10.1177/2047487314547657
Kacin, A., Rosenblatt, B., Zargi, T. G., and Biswas, A. (2015). Safety considerations with blood flow restricted resistance training. Varna Uporaba Vadbe Z Zmanjšanim Pretokom Krvi. Ann. Kinesiol. 6, 3–26.
Kacin, A., and Strazar, K. (2011). Frequent low-load ischemic resistance exercise to failure enhances muscle oxygen delivery and endurance capacity. Scand. J. Med. Sci. Sports 21, e231–e241. doi: 10.1111/j.1600-0838.2010.01260.x
Kang, D. Y., Kim, H. S., Lee, K. S., and Kim, Y. M. (2015). The effects of bodyweight-based exercise with blood flow restriction on isokinetic knee muscular function and thigh circumference in college students. J. Phys. Ther. Sci. 27, 2709–2712. doi: 10.1589/jpts.27.2709
Kim, D., Loenneke, J. P., Ye, X., Bemben, D. A., Beck, T. W., Larson, R. D., et al. (2017). Low-load resistance training with low relative pressure produces muscular changes similar to high-load resistance training. Muscle Nerve 56, E126–E133. doi: 10.1002/mus.25626
Kimura, M., Ueda, K., Goto, C., Jitsuiki, D., Nishioka, K., Umemura, T., et al. (2007). Repetition of ischemic preconditioning augments endothelium-dependent vasodilation in humans: role of endothelium-derived nitric oxide and endothelial progenitor cells. Arterioscler. Thromb. Vasc. Biol. 27, 1403–1410. doi: 10.1161/ATVBAHA.107.143578
Klatsky, A. L., Armstrong, M. A., and Poggi, J. (2000). Risk of pulmonary embolism and/or deep venous thrombosis in Asian-Americans. Am. J. Cardiol. 85, 1334–1337. doi: 10.1016/s0002-9149(00)00766-9
Kraemer, W. J., and Ratamess, N. A. (2004). Fundamentals of resistance training: progression and exercise prescription. Med. Sci. Sports Exerc. 36, 674–688. doi: 10.1249/01.mss.0000121945.36635.61
Kubota, A., Sakuraba, K., Koh, S., Ogura, Y., and Tamura, Y. (2011). Blood flow restriction by low compressive force prevents disuse muscular weakness. J. Sci. Med. Sport 14, 95–99. doi: 10.1016/j.jsams.2010.08.007
Kubota, A., Sakuraba, K., Sawaki, K., Sumide, T., and Tamura, Y. (2008). Prevention of disuse muscular weakness by restriction of blood flow. Med. Sci. Sports Exerc. 40, 529–534. doi: 10.1249/MSS.0b013e31815ddac6
Kucher, N. (2011). Deep-vein thrombosis of the upper extremities. N. Engl. J. Med. 364, 861–869. doi: 10.1056/nejmcp1008740
Kumagai, K., Kurobe, K., Zhong, H., Loenneke, J. P., Thiebaud, R. S., Ogita, F., et al. (2012). Cardiovascular drift during low intensity exercise with leg blood flow restriction. Acta Physiol. Hung. 99, 392–399. doi: 10.1556/APhysiol.99.2012.4.3
Ladlow, P., Coppack, R. J., Dharm-Datta, S., Conway, D., Sellon, E., Patterson, S. D., et al. (2018). Low-load resistance training with blood flow restriction improves clinical outcomes in musculoskeletal rehabilitation: a single-blind randomized controlled trial. Front. Physiol. 9:1269. doi: 10.3389/fphys.2018.01269
Larkin, K. A., Macneil, R. G., Dirain, M., Sandesara, B., Manini, T. M., and Buford, T. W. (2012). Blood flow restriction enhances post-resistance exercise angiogenic gene expression. Med. Sci. Sports Exerc. 44, 2077–2083. doi: 10.1249/MSS.0b013e3182625928
Laurentino, G., Ugrinowitsch, C., Aihara, A. Y., Fernandes, A. R., Parcell, A. C., Ricard, M., et al. (2008). Effects of strength training and vascular occlusion. Int. J. Sports Med. 29, 664–667. doi: 10.1055/s-2007-989405
Laurentino, G. C., Loenneke, J. P., Teixeira, E. L., Nakajima, E., Iared, W., and Tricoli, V. (2016). The effect of cuff width on muscle adaptations after blood flow restriction training. Med. Sci. Sports Exerc. 48, 920–925. doi: 10.1249/MSS.0000000000000833
Libardi, C. A., Catai, A. M., Miquelini, M., Borghi-Silva, A., Minatel, V., Alvarez, I. F., et al. (2017). Hemodynamic responses to blood flow restriction and resistance exercise to muscular failure. Int. J. Sports Med. 38, 134–140. doi: 10.1055/s-0042-115032
Libardi, C. A., Chacon-Mikahil, M. P., Cavaglieri, C. R., Tricoli, V., Roschel, H., Vechin, F. C., et al. (2015). Effect of concurrent training with blood flow restriction in the elderly. Int. J. Sports Med. 36, 395–399. doi: 10.1055/s-0034-1390496
Lixandrão, M. E., Ugrinowitsch, C., Berton, R., Vechin, F. C., Conceição, M. S., Damas, F., et al. (2018). Magnitude of muscle strength and mass adaptations between high-load resistance training versus low-load resistance training associated with blood flow restriction: a systematic review and meta-analysis. Sports Med. 48, 361–378. doi: 10.1007/s40279-017-0795-y
Lixandrao, M. E., Ugrinowitsch, C., Laurentino, G., Libardi, C. A., Aihara, A. Y., Cardoso, F. N., et al. (2015). Effects of exercise intensity and occlusion pressure after 12 weeks of resistance training with blood-flow restriction. Eur. J. Appl. Physiol. 115, 2471–2480. doi: 10.1007/s00421-015-3253-2
Loenneke, J. P., Allen, K. M., Mouser, J. G., Thiebaud, R. S., Kim, D., Abe, T., et al. (2015). Blood flow restriction in the upper and lower limbs is predicted by limb circumference and systolic blood pressure. Eur. J. Appl. Physiol. 115, 397–405. doi: 10.1007/s00421-014-3030-7
Loenneke, J. P., Balapur, A., Thrower, A. D., Barnes, J. T., and Pujol, T. J. (2011a). The perceptual responses to occluded exercise. Int. J. Sports Med. 32, 181–184. doi: 10.1055/s-0030-1268472
Loenneke, J. P., Fahs, C. A., Wilson, J. M., and Bemben, M. G. (2011b). Blood flow restriction: the metabolite/volume threshold theory. Med. Hypotheses 77, 748–752. doi: 10.1016/j.mehy.2011.07.029
Loenneke, J. P., Kearney, M. L., Thrower, A. D., Collins, S., and Pujol, T. J. (2010). The acute response of practical occlusion in the knee extensors. J. Strength Cond. Res. 24, 2831–2834. doi: 10.1519/JSC.0b013e3181f0ac3a
Loenneke, J. P., Loprinzi, P. D., Abe, T., Thiebaud, R. S., Allen, K. M., Grant Mouser, J., et al. (2016). Arm circumference influences blood pressure even when applying the correct cuff size: is a further correction needed? Int. J. Cardiol. 202, 743–744. doi: 10.1016/j.ijcard.2015.10.009
Loenneke, J. P., Thiebaud, R. S., Fahs, C. A., Rossow, L. M., Abe, T., and Bemben, M. G. (2013). Effect of cuff type on arterial occlusion. Clin. Physiol. Funct. Imaging 33, 325–327. doi: 10.1111/cpf.12035
Loenneke, J. P., Thiebaud, R. S., and Abe, T. (2014a). Does blood flow restriction result in skeletal muscle damage? A critical review of available evidence. Scand. J. Med. Sci. Sports 24, e415–e422. doi: 10.1111/sms.12210
Loenneke, J. P., Thiebaud, R. S., Fahs, C. A., Rossow, L. M., Abe, T., and Bemben, M. G. (2014b). Blood flow restriction: effects of cuff type on fatigue and perceptual responses to resistance exercise. Acta Physiol. Hung. 101, 158–166. doi: 10.1556/APhysiol.101.2014.2.4
Loenneke, J. P., Balapur, A., Thrower, A. D., Barnes, J., and Pujol, T. J. (2012a). Blood flow restriction reduces time to muscular failure. Eur. J. Sport Sci. 12, 238–248.
Loenneke, J. P., Fahs, C. A., Rossow, L. M., Sherk, V. D., Thiebaud, R. S., Abe, T., et al. (2012b). Effects of cuff width on arterial occlusion: implications for blood flow restricted exercise. Eur. J. Appl. Physiol. 112, 2903–2912. doi: 10.1007/s00421-011-2266-8
Loenneke, J. P., Fahs, C. A., Thiebaud, R. S., Rossow, L. M., Abe, T., Ye, X., et al. (2012c). The acute muscle swelling effects of blood flow restriction. Acta Physiol. Hung. 99, 400–410. doi: 10.1556/APhysiol.99.2012.4.4
Loenneke, J. P., Wilson, J. M., Marín, P. J., Zourdos, M. C., and Bemben, M. G. (2012d). Low intensity blood flow restriction training: a meta-analysis. Eur. J. Appl. Physiol. 112, 1849–1859. doi: 10.1007/s00421-011-2167-x
Luebbers, P. E., Fry, A. C., Kriley, L. M., and Butler, M. S. (2014). The effects of a 7-week practical blood flow restriction program on well-trained collegiate athletes. J. Strength Cond. Res. 28, 2270–2280. doi: 10.1519/JSC.0000000000000385
Madarame, H., Kurano, M., Fukumura, K., Fukuda, T., and Nakajima, T. (2013). Haemostatic and inflammatory responses to blood flow-restricted exercise in patients with ischaemic heart disease: a pilot study. Clin. Physiol. Funct. Imaging 33, 11–17. doi: 10.1111/j.1475-097X.2012.01158.x
Madarame, H., Kurano, M., Takano, H., Iida, H., Sato, Y., Ohshima, H., et al. (2010). Effects of low-intensity resistance exercise with blood flow restriction on coagulation system in healthy subjects. Clin. Physiol. Funct. Imaging 30, 210–213. doi: 10.1111/j.1475-097X.2010.00927.x
Madarame, H., Neya, M., Ochi, E., Nakazato, K., Sato, Y., and Ishii, N. (2008). Cross-transfer effects of resistance training with blood flow restriction. Med. Sci. Sports Exerc. 40, 258–263. doi: 10.1249/mss.0b013e31815c6d7e
Manimmanakorn, A., Hamlin, M. J., Ross, J. J., Taylor, R., and Manimmanakorn, N. (2013). Effects of low-load resistance training combined with blood flow restriction or hypoxia on muscle function and performance in netball athletes. J. Sci. Med. Sport 16, 337–342. doi: 10.1016/j.jsams.2012.08.009
Manini, T. M., and Clark, B. C. (2009). Blood flow restricted exercise and skeletal muscle health. Exerc. Sport Sci. Rev. 37, 78–85. doi: 10.1097/JES.0b013e31819c2e5c
Manini, T. M., Yarrow, J. F., Buford, T. W., Clark, B. C., Conover, C. F., and Borst, S. E. (2012). Growth hormone responses to acute resistance exercise with vascular restriction in young and old men. Growth Horm. IGF Res. 22, 167–172. doi: 10.1016/j.ghir.2012.05.002
Martín-Hernández, J., Marin, P. J., Menéndez, H., Ferrero, C., Loenneke, J. P., and Herrero, A. J. (2013). Muscular adaptations after two different volumes of blood flow-restricted training. Scand. J. Med. Sci. Sports 23, 114–120. doi: 10.1111/sms.12036
Mattocks, K. T., Jessee, M. B., Counts, B. R., Buckner, S. L., Grant Mouser, J., Dankel, S. J., et al. (2017). The effects of upper body exercise across different levels of blood flow restriction on arterial occlusion pressure and perceptual responses. Physiol. Behav. 171, 181–186. doi: 10.1016/j.physbeh.2017.01.015
May, A. K., Brandner, C. R., and Warmington, S. A. (2017). Hemodynamic responses are reduced with aerobic compared with resistance blood flow restriction exercise. Physiol. Rep. 5:e13142. doi: 10.14814/phy2.13142
McEwen, J. A., Owens, J. G., and Jeyasurya, J. (2018). Why is it crucial to use personalized occlusion pressures in blood flow restriction (BFR) rehabilitation? J. Med. Biol. Eng. 39, 7–11.
Moore, D. R., Burgomaster, K. A., Schofield, L. M., Gibala, M. J., Sale, D. G., and Phillips, S. M. (2004). Neuromuscular adaptations in human muscle following low intensity resistance training with vascular occlusion. Eur. J. Appl. Physiol. 92, 399–406.
Mouser, J. G., Dankel, S. J., Jessee, M. B., Mattocks, K. T., Buckner, S. L., Counts, B. R., et al. (2017a). A tale of three cuffs: the hemodynamics of blood flow restriction. Eur. J. Appl. Physiol. 117, 1493–1499. doi: 10.1007/s00421-017-3644-7
Mouser, J. G., Laurentino, G. C., Dankel, S. J., Buckner, S. L., Jessee, M. B., Counts, B. R., et al. (2017b). Blood flow in humans following low-load exercise with and without blood flow restriction. Appl. Physiol. Nutr. Metab. 42, 1165–1171. doi: 10.1139/apnm-2017-0102
Murrant, C. L., and Sarelius, I. H. (2015). Local control of blood flow during active hyperaemia: what kinds of integration are important? J. Physiol. 593, 4699–4711. doi: 10.1113/JP270205
Nakajima, T., Kurano, M., Iida, H., Takano, H., Oonuma, H., Morita, T., et al. (2006). Use and safety of KAATSU training: results of a national survey. Int. J. KAATSU Train. Res. 2, 5–13. doi: 10.3806/ijktr.2.5
Nakajima, T., Takano, H., Kurano, M., Iida, H., Kubota, N., Yasuda, T., et al. (2007). Effects of KAATSU training on haemostasis in healthy subjects. Int. J. KAATSU Train. Res. 3, 11–20. doi: 10.2147/IJGM.S194883
Natsume, T., Ozaki, H., Kakigi, R., Kobayashi, H., and Naito, H. (2018). Effects of training intensity in electromyostimulation on human skeletal muscle. Eur. J. Appl. Physiol. 118, 1339–1347. doi: 10.1007/s00421-018-3866-3
Natsume, T., Ozaki, H., Saito, A. I., Abe, T., and Naito, H. (2015). Effects of electrostimulation with blood flow restriction on muscle size and strength. Med. Sci. Sports Exerc. 47, 2621–2627. doi: 10.1249/MSS.0000000000000722
Neto, G. R., Sousa, M. S., Costa e Silva, G. V., Gil, A. L., Salles, B. F., and Novaes, J. S. (2016). Acute resistance exercise with blood flow restriction effects on heart rate, double product, oxygen saturation and perceived exertion. Clin. Physiol. Funct. Imaging 36, 53–59. doi: 10.1111/cpf.12193
Nielsen, J. L., Aagaard, P., Bech, R. D., Nygaard, T., Hvid, L. G., Wernbom, M., et al. (2012). Proliferation of myogenic stem cells in human skeletal muscle in response to low-load resistance training with blood flow restriction. J. Physiol. 590, 4351–4361. doi: 10.1113/jphysiol.2012.237008
Nielsen, J. L., Aagaard, P., Prokhorova, T. A., Nygaard, T., Bech, R. D., Suetta, C., et al. (2017a). Blood flow restricted training leads to myocellular macrophage infiltration and upregulation of heat shock proteins, but no apparent muscle damage. J. Physiol. 595, 4857–4873. doi: 10.1113/JP273907
Nielsen, J. L., Frandsen, U., Prokhorova, T., Bech, R. D., Nygaard, T., Suetta, C., et al. (2017b). Delayed effect of blood flow-restricted resistance training on rapid force capacity. Med. Sci. Sports Exerc. 49, 1157–1167. doi: 10.1249/MSS.0000000000001208
Nikolaidis, M. G., Paschalis, V., Giakas, G., Fatouros, I. G., Koutedakis, Y., Kouretas, D., et al. (2007). Decreased blood oxidative stress after repeated muscle-damaging exercise. Med. Sci. Sports Exerc. 39, 1080–1089. doi: 10.1249/mss.0b013e31804ca10c
Nosaka, K., and Newton, M. (2002). Concentric or eccentric training effect on eccentric exercise-induced muscle damage. Med. Sci. Sports Exerc. 34, 63–69. doi: 10.1097/00005768-200201000-00011
Ogasawara, R., Loenneke, J. P., Thiebaud, R. S., and Abe, T. (2013). Low-load bench press training to fatigue results in muscle hypertrophy similar to high-load bench press training. Int. J. Clin. Med. 4, 114–121. doi: 10.4236/ijcm.2013.42022
Ohta, H., Kurosawa, H., Ikeda, H., Iwase, Y., Satou, N., and Nakamura, S. (2003). Low-load resistance muscular training with moderate restriction of blood flow after anterior cruciate ligament reconstruction. Acta Orthop. Scand. 74, 62–68. doi: 10.1080/00016470310013680
Ozaki, H., Miyachi, M., Nakajima, T., and Abe, T. (2011a). Effects of 10 weeks walk training with leg blood flow reduction on carotid arterial compliance and muscle size in the elderly adults. Angiology 62, 81–86. doi: 10.1177/0003319710375942
Ozaki, H., Yasuda, T., Fujita, S., Ogasawara, R., Sugaya, M., Nakajima, T., et al. (2011b). Increases in thigh muscle volume and strength by walk training with leg blood flow reduction in older participants. J. Gerontol. A Biol. Sci. Med. Sci. 66, 257–263. doi: 10.1093/gerona/glq182
Ozaki, H., Yasuda, T., Ogasawara, R., Sakamaki-Sunaga, M., Naito, H., and Abe, T. (2013). Effects of high-intensity and blood flow-restricted low-intensity resistance training on carotid arterial compliance: role of blood pressure during training sessions. Eur. J. Appl. Physiol. 113, 167–174. doi: 10.1007/s00421-012-2422-9
Park, S., Kim, J. K., Choi, H. M., Kim, H. G., Beekley, M. D., and Nho, H. (2010). Increase in maximal oxygen uptake following 2-week walk training with blood flow occlusion in athletes. Eur. J. Appl. Physiol. 109, 591–600. doi: 10.1007/s00421-010-1377-y
Patterson, S. D., and Brandner, C. R. (2017). The role of blood flow restriction training for applied practitioners: a questionnaire-based survey. J. Sports Sci. 36, 123–130. doi: 10.1080/02640414.2017.1284341
Patterson, S. D., and Ferguson, R. A. (2010). Increase in calf post-occlusive blood flow and strength following short-term resistance exercise training with blood flow restriction in young women. Eur. J. Appl. Physiol. 108, 1025–1033. doi: 10.1007/s00421-009-1309-x
Patterson, S. D., and Ferguson, R. A. (2011). Enhancing strength and postocclusive calf blood flow in older people with training with blood-flow restriction. J. Aging Phys. Act. 19, 201–213. doi: 10.1123/japa.19.3.201
Patterson, S. D., Hughes, L., Head, P., Warmington, S., and Brandner, C. R. (2017). Blood flow restriction training: a novel approach to augment clinical rehabilitation: how to do it. Br. J. Sports Med. 51, 1648–1649. doi: 10.1136/bjsports-2017-097738
Pearson, S. J., and Hussain, S. R. (2015). A review on the mechanisms of blood-flow restriction resistance training-induced muscle hypertrophy. Sports Med. 45, 187–200. doi: 10.1007/s40279-014-0264-9
Pizza, F. X., Koh, T. J., McGregor, S. J., and Brooks, S. V. (2002). Muscle inflammatory cells after passive stretches, isometric contractions, and lengthening contractions. J. Appl. Physiol. 92, 1873–1878. doi: 10.1152/japplphysiol.01055.2001
Poton, R., and Polito, M. D. (2015). Hemodynamic responses during lower-limb resistance exercise with blood flow restriction in healthy subjects. J. Sports Med. Phys. Fitness 55, 1571–1577.
Poton, R., and Polito, M. D. (2016). Hemodynamic response to resistance exercise with and without blood flow restriction in healthy subjects. Clin. Physiol. Funct. Imaging 36, 231–236. doi: 10.1111/cpf.12218
Proske, U., and Morgan, D. L. (2001). Muscle damage from eccentric exercise: mechanism, mechanical signs, adaptation and clinical applications. J. Physiol. 537(Pt 2), 333–345. doi: 10.1111/j.1469-7793.2001.00333.x
Raskob, G. E., Angchaisuksiri, P., Blanco, A. N., Buller, H., Gallus, A., Hunt, B. J., et al. (2014). Thrombosis: a major contributor to global disease burden. Arterioscler. Thromb. Vasc. Biol. 34, 2363–2371. doi: 10.1161/ATVBAHA.114.304488
Reid, M. B., and Durham, W. J. (2002). Generation of reactive oxygen and nitrogen species in contracting skeletal muscle. Ann. N. Y. Acad. Sci. 959, 108–116. doi: 10.1111/j.1749-6632.2002.tb02087.x
Renzi, C. P., Tanaka, H., and Sugawara, J. (2010). Effects of leg blood flow restriction during walking on cardiovascular function. Med. Sci. Sports Exerc. 42, 726–732. doi: 10.1249/MSS.0b013e3181bdb454
Rodriguez, M. C., Rosenfeld, J., and Tarnopolsky, M. A. (2003). Plasma malondialdehyde increases transiently after ischemic forearm exercise. Med. Sci. Sports Exerc. 35, 1859–1865. doi: 10.1249/01.mss.0000093609.75937.70
Rossow, L. M., Fahs, C. A., Loenneke, J. P., Thiebaud, R. S., Sherk, V. D., Abe, T., et al. (2012). Cardiovascular and perceptual responses to blood-flow-restricted resistance exercise with differing restrictive cuffs. Clin. Physiol. Funct. Imaging 32, 331–337. doi: 10.1111/j.1475-097X.2012.01131.x
Rossow, L. M., Fahs, C. A., Sherk, V. D., Seo, D. I., Bemben, D. A., and Bemben, M. G. (2011). The effect of acute blood-flow-restricted resistance exercise on postexercise blood pressure. Clin. Physiol. Funct. Imaging 31, 429–434. doi: 10.1111/j.1475-097X.2011.01038.x
Sakamaki, M. G., Bemben, M., and Abe, T. (2011). Legs and trunk muscle hypertrophy following walk training with restricted leg muscle blood flow. J. Sports Sci. Med. 10, 338–340.
Saltin, B., Rådegran, G., Koskolou, M. D., and Roach, R. C. (1998). Skeletal muscle blood flow in humans and its regulation during exercise. Acta Physiol. Scand. 162, 421–436. doi: 10.1046/j.1365-201x.1998.0293e.x
Scott, B. R., Loenneke, J. P., Slattery, K. M., and Dascombe, B. J. (2015). Exercise with blood flow restriction: an updated evidence-based approach for enhanced muscular development. Sports Med. 45, 313–325. doi: 10.1007/s40279-014-0288-1
Sieljacks, P., Matzon, A., Wernbom, M., Ringgaard, S., Vissing, K., and Overgaard, K. (2016). Muscle damage and repeated bout effect following blood flow restricted exercise. Eur. J. Appl. Physiol. 116, 513–525. doi: 10.1007/s00421-015-3304-8
Silverstein, M. D., Heit, J. A., Mohr, D. N., Petterson, T. M., O’Fallon, W. M., and Melton, L. J. III (1998). Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study. Arch. Intern. Med. 158, 585–593.
Slysz, J., Stultz, J., and Burr, J. F. (2016). The efficacy of blood flow restricted exercise: a systematic review & meta-analysis. J. Sci. Med. Sport 19, 669–675. doi: 10.1016/j.jsams.2015.09.005
Slysz, J. T., and Burr, J. F. (2018). The effects of blood flow restricted electrostimulation on strength and hypertrophy. J. Sport Rehabil. 27, 257–262. doi: 10.1123/jsr.2017-0002
Staunton, C. A., May, A. K., Brandner, C. R., and Warmington, S. A. (2015). Haemodynamics of aerobic and resistance blood flow restriction exercise in young and older adults. Eur. J. Appl. Physiol. 115, 2293–2302. doi: 10.1007/s00421-015-3213-x
Stegnar, M., and Pentek, M. (1993). Fibrinolytic response to venous occlusion in healthy subjects: relationship to age, gender, body weight, blood lipids and insulin. Thromb. Res. 69, 81–92. doi: 10.1016/0049-3848(93)90005-9
Sugawara, J., Tsubasa, T., and Hirofumi, T. (2015). Impact of leg blood flow restriction during walking on central arterial hemodynamics. Am. J. Physiol. Regul. Integr. Comp. Physiol. 309, R732–R739. doi: 10.1152/ajpregu.00095.2015
Tabata, S., Suzuki, Y., and Azuma, K. (2016). Rhabdomyolysis after performing blood flow restriction training: a case report. J. Strength Cond. Res. 30, 2064–2068. doi: 10.1519/JSC.0000000000001295
Takano, H., Morita, T., Iida, H., Asada, K., Kato, M., Uno, K., et al. (2005). Hemodynamic and hormonal responses to a short-term low-intensity resistance exercise with the reduction of muscle blood flow. Eur. J. Appl. Physiol. 95, 65–73. doi: 10.1007/s00421-005-1389-1
Takano, N., Kusumi, M., and Takano, H. (2013). Evaluation of fetal status during KAATSU training®in the third trimester of pregnancy. Int. J. KAATSU Train. Res. 9, 7–11. doi: 10.3806/ijktr.9.7
Takarada, Y., Sato, Y., and Ishii, N. (2002). Effects of resistance exercise combined with vascular occlusion on muscle function in athletes. Eur. J. Appl. Physiol. 86, 308–314. doi: 10.1007/s00421-001-0561-5
Takarada, Y., Nakamura, Y., Aruga, S., Onda, T., Miyazaki, S., and Ishii, N. (2000a). Rapid increase in plasma growth hormone after low-intensity resistance exercise with vascular occlusion. J. Appl. Physiol. 88, 61–65. doi: 10.1152/jappl.2000.88.1.61
Takarada, Y., Takazawa, H., and Ishii, N. (2000b). Applications of vascular occlusion diminish disuse atrophy of knee extensor muscles. Med. Sci. Sports Exerc. 32, 2035–2039. doi: 10.1097/00005768-200012000-00011
Takarada, Y., Takazawa, H., Sato, Y., Takebayashi, S., Tanaka, Y., and Ishii, N. (2000c). Effects of resistance exercise combined with moderate vascular occlusion on muscular function in humans. J. Appl. Physiol. 88, 2097–2106. doi: 10.1152/jappl.2000.88.6.2097
Takarada, Y., Tsuruta, T., and Ishii, N. (2004). Cooperative effects of exercise and occlusive stimuli on muscular function in low-intensity resistance exercise with moderate vascular occlusion. Jpn. J. Physiol. 54, 585–592. doi: 10.2170/jjphysiol.54.585
Taylor, C. W., Ingham, S. A., and Ferguson, R. A. (2016). Acute and chronic effect of sprint interval training combined with postexercise blood-flow restriction in trained individuals. Exp. Physiol. 101, 143–154. doi: 10.1113/EP085293
Tennent, D. J., Hylden, C. M., Johnson, A. E., Burns, T. C., Wilken, J. M., and Owens, J. G. (2017). Blood flow restriction training after knee arthroscopy: a randomized controlled pilot study. Clin. J. Sport Med. 27, 245–252. doi: 10.1097/JSM.0000000000000377
Thiebaud, R. S., Loenneke, J. P., Fahs, C. A., Kim, D., Ye, X., Abe, T., et al. (2014). Muscle damage after low-intensity eccentric contractions with blood flow restriction. Acta Physiol. Hung. 101, 150–157. doi: 10.1556/APhysiol.101.2014.2.3
Thiebaud, R. S., Yasuda, T., Loenneke, J. P., and Abe, T. (2013). Effects of low-intensity concentric and eccentric exercise combined with blood flow restriction on indices of exercise-induced muscle damage. Interv. Med. Appl. Sci. 5, 53–59. doi: 10.1556/IMAS.5.2013.2.1
Thompson, K. M. A., Slysz, J. T., and Burr, J. F. (2018). Risks of exertional rhabdomyolysis with blood flow–restricted training: beyond the case report. Clin. J. Sport Med. 28, 491–492. doi: 10.1097/jsm.0000000000000488
Tietze, D. C., and Borchers, J. (2014). Exertional rhabdomyolysis in the athlete: a clinical review. Sports Health 6, 336–339. doi: 10.1177/1941738114523544
Umbel, J. D., Hoffman, R. L., Dearth, D. J., Chleboun, G. S., Manini, T. M., and Clark, B. C. (2009). Delayed-onset muscle soreness induced by low-load blood flow-restricted exercise. Eur. J. Appl. Physiol. 107, 687–695. doi: 10.1007/s00421-009-1175-6
Vieira, P. J., Chiappa, G. R., Umpierre, D., Stein, R., and Ribeiro, J. P. (2013). Hemodynamic responses to resistance exercise with restricted blood flow in young and older men. J. Strength Cond. Res. 27, 2288–2294. doi: 10.1519/JSC.0b013e318278f21f
Wells, P. S., Anderson, D. R., and Ginsberg, J. (2000). Assessment of deep vein thrombosis or pulmonary embolism by the combined use of clinical model and noninvasive diagnostic tests. Semin. Thromb. Hemost. 26, 643–656. doi: 10.1055/s-2000-13219
Wernbom, M., Augustsson, J., and Raastad, T. (2008). Ischemic strength training: a low-load alternative to heavy resistance exercise? Scand. J. Med. Sci. Sports 18, 401–416. doi: 10.1111/j.1600-0838.2008.00788.x
Wernbom, M., Paulsen, G., Nilsen, T. S., Hisdal, J., and Raastad, T. (2012). Contractile function and sarcolemmal permeability after acute low-load resistance exercise with blood flow restriction. Eur. J. Appl. Physiol. 112, 2051–2063. doi: 10.1007/s00421-011-2172-0
Wilson, J. M., Lowery, R. P., Joy, J. M., Loenneke, J. P., and Naimo, M. A. (2013). Practical blood flow restriction training increases acute determinants of hypertrophy without increasing indices of muscle damage. J. Strength Cond. Res. 27, 3068–3075. doi: 10.1519/JSC.0b013e31828a1ffa
Yasuda, T., Abe, T., Sato, Y., Midorikawa, T., Kearns, C. F., Inoue, K., et al. (2005). Muscle fiber cross-sectional area is increased after two weeks of twice daily KAATSU-resistance training. Int. J. KAATSU Train. Res. 1, 65–70. doi: 10.3806/ijktr.1.65
Yasuda, T., Abe, T., Brechue, W. F., Iida, H., Takano, H., Meguro, K., et al. (2010a). Venous blood gas and metabolite response to low-intensity muscle contractions with external limb compression. Metabolism 59, 1510–1519. doi: 10.1016/j.metabol.2010.01.016
Yasuda, T., Fujita, S., Ogasawara, R., Sato, Y., and Abe, T. (2010b). Effects of low-intensity bench press training with restricted arm muscle blood flow on chest muscle hypertrophy: a pilot study. Clin. Physiol. Funct. Imaging 30, 338–343. doi: 10.1111/j.1475-097X.2010.00949.x
Yasuda, T., Fukumura, K., Tomaru, T., and Nakajima, T. (2016). Thigh muscle size and vascular function after blood flow-restricted elastic band training in older women. Oncotarget 7, 33595–33607. doi: 10.18632/oncotarget.9564
Yasuda, T., Fukumura, K., Iida, H., and Nakajima, T. (2015a). Effects of detraining after blood flow-restricted low-load elastic band training on muscle size and arterial stiffness in older women. Springerplus 4:348. doi: 10.1186/s40064-015-1132-2
Yasuda, T., Fukumura, K., Uchida, Y., Koshi, H., Iida, H., Masamune, K., et al. (2015b). Effects of low-load, elastic band resistance training combined with blood flow restriction on muscle size and arterial stiffness in older adults. J. Gerontol. A Biol. Sci. Med. Sci. 70, 950–958. doi: 10.1093/gerona/glu084
Yasuda, T., Loenneke, J. P., Ogasawara, R., and Abe, T. (2013). Influence of continuous or intermittent blood flow restriction on muscle activation during low-intensity multiple sets of resistance exercise. Acta Physiol. Hung. 100, 419–426. doi: 10.1556/APhysiol.100.2013.4.6
Yasuda, T., Loenneke, J. P., Thiebaud, R. S., and Abe, T. (2012). Effects of Blood flow restricted low-intensity concentric or eccentric training on muscle size and strength. PLoS One 7:e52843. doi: 10.1371/journal.pone.0052843
Yasuda, T., Miyagi, Y., Kubota, Y., Sato, Y., Nakajima, T., Bemben, M. G., et al. (2006). Electromyographic responses of arm and chest muscle during bench press exercise with and without KAATSU. Int. J. KAATSU Train. Res. 2, 15–18. doi: 10.3806/ijktr.2.15
Yasuda, T., Ogasawara, R., Sakamaki, M., Bemben, M. G., and Abe, T. (2011a). Relationship between limb and trunk muscle hypertrophy following high-intensity resistance training and blood flow restricted low-intensity resistance training. Clin. Physiol. Funct. Imaging 31, 347–351. doi: 10.1111/j.1475-097X.2011.01022.x
Yasuda, T., Ogasawara, R., Sakamaki, M., Ozaki, H., Sato, Y., and Abe, T. (2011b). Combined effects of lowintensity blood flow restriction training and high-intensity resistance training on muscle strength and size. Eur. J. Appl. Physiol. 111, 2525–2533. doi: 10.1007/s00421-011-1873-8
Yeung, E. W., Whitehead, N. P., Suchyna, T. M., Gottlieb, P. A., Sachs, F., and Allen, D. G. (2005). Effects of stretch-activated channel blockers on (Ca2+)i and muscle damage in the mdx mouse. J. Physiol. 562(Pt 2), 367–380. doi: 10.1113/jphysiol.2004.075275
Younger, A. S., McEwen, J. A., and Inkpen, K. (2004). Wide contoured thigh cuffs and automated limb occlusion measurement allow lower tourniquet pressures. Clin. Orthop. 428, 286–293. doi: 10.1097/01.blo.0000142625.82654.b3
Zimmerman, J. L., and Shen, M. C. (2013). Rhabdomyolysis. Chest 144, 1058–1065. doi: 10.1378/chest.12-2016

2 پاسخ
ممنون از مقاله خوبتون
ممنون از لطف شما
خوشحال میشیم مقالات دیگر رو هم مطالعه بفرمایید